Разработка методов и средств реабилитации объектов отравляющих веществ
Содержание соединений с С-Р связью определяют по разнице между количеством общего и неорганического фосфора. Концентрацию фосфора общего определяют на спектрофотометре по образованию комплекса фосфомолибдата с малахитовым зеленым при низких значениях рН после гидролиза с персульфатом аммония, в ходе которого происходит разрыв С-Р связи и высвобождение фосфат-иона. Соотношение предварительно разведенной культуральной жидкости и персульфата аммония было 1:1.
Пробы культуральной жидкости отбирали в эппендорфы для анализа, центрифугировали 10 тыс. об./мин - 2 мин, супернатант хранили в замороженном виде для разрыва С-Р связи ГФ в стеклянных пробирках проводили гидролиз проб с персульфатом аммония. Для приготовления раствора персульфата 8 г персульфата аммония растворяли в 20 мл дистиллированной Н2О. Смешивали пробу и раствор персульфата аммония в соотношении 1:1 в стеклянных пробирках, которые закрывали фольгой и закрепляли ее резиновыми кольцами. Гидролиз проводили в течение 60 мин. при 900C на водяной бане.
Вносили в эппендорфы компоненты реакции в соотношении: 130 мкл 1н H2SO4-, 130 мкл пробы, 1300 мкл раствора С. Смесь тщательно перемешивали. Через 10-15 минут измеряли ОП при длине волны 645 нм (ОП645) в кювете 1 см, в линейной области значений ОП от 0,2 до 0,5. В качестве контроля использовали образец культуральной жидкости без добавления персульфата аммония.
Приготовление растворов:
Раствор А: 90 мг малахитового зеленого растворяли в 200 мл дистилированной воды при перемешивании в течение 30 мин. на магнитной мешалке;
Раствор В: 8,4 г молибдата аммония растворяли в 60 мл HСl конц в течение 20 мин. при перемешивании стеклянной палочкой; после растворения молибдата аммония в HCl конц. добавляли полученный раствор к 138 мл дистиллированной Н2О.
Раствор С: смешивали по 200 мл растворов А и В, перемешивали в пластиковой емкости на магнитной мешалке в течение 30 мин., фильтровали полученный раствор С через плотный бумажный фильтр в пластиковую посуду. Раствор С использовали для анализа. Хранили в холодильнике, в течение надели. Перед каждым употреблением фильтровали через бумажный фильтр.
3. Обсуждение результатов
3.1 Отбор штаммов микроорганизмов-деструкторов
фосфорорганических соединений
Для скрининга использовали коллекцию штаммов Pseudomonas и Alcaligenes лаборатории института биохимии и физиологии растений и микроорганизмов РАН. В качестве субстрата использовали МФК.
Образование зон «просветления» на среде, содержащей МФК, представлено на рисунке 6.
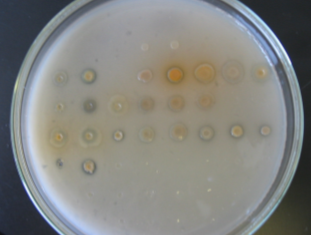
Рисунок 6 – Образование зон «просветления» различными штаммами
1 – KR31; 2 – Sm12; 3 – Km12; 4 – 2-79; 5 – Pf-5; 6 – Q2 – 87; 7 – CHAQ1;
8 – Sm11; 9 – UC 5; 10 – PCLB 91; 11 – 38а; 12 – 53a; 13 – 54; 14 – 1217;
15 – 7Н; 16 – 90Н; 17 – 70А; 18 – IG1; 19 – OV17; 20 – 1С7; 21 – IIД 5;
22 – VB1; 23 –OV9; 24 – 29; 25 – 19; 26 – 25р; 27 – AS15.
Как видно из рисунка 6, наибольшей способностью к усилению растворения МФК обладают штаммы 2-79, Pf-5, P54, 1C7, относящиеся к роду Pseudomonas fluorescens. Наилучшая способность к растворению метилфосфонатов отмечается у штамма Sm11 , относящегося к роду Alcaligenes sp.
Таким образом, биодоступность МФК можно достичь внесением в почву штамма Sm11 бактерий рода Alcaligenes sp. Поэтому для изучения эффективности биодеструкции фосфорорганических соединений выбран именно этот штамм.
3.2 Биодеструкция метилфосфоновой кислоты и её кислых эфиров
Из литературных данных известно, что неорганический фосфат ингибирует потребление органофосфонатов в качестве источника фосфора разложение МФК [33-35]. При выращивании посевного материала на агаризованной среде, по-видимому, возможна экстракция из агара и накопление в клетках более доступных, чем МФК, источников фосфора, которые могут попадать в экспериментальную среду вместе с посевным материалом. Более доступный фосфор может находиться на поверхности агара, образуясь в процессе жизнедеятельности культуры из МФК при наращивании биомассы. Поэтому, к тому времени, как биомасса на агаризованной среде нарастет до необходимого уровня, в клетках посевного материала могут быть запасные источники фосфора, за счет которых культура будет расти в среде с МФК, не разлагая его. Чтобы исключить все эти факторы необходимо иметь клетки посевного материала, голодные по фосфору. Для решения этой проблемы необходимо суспензию клеток, используемую в качестве посевного материала, инкубировать в среде с глутаматом (источником углерода), но без источника фосфора в течение трех суток. В это время можно считать клетки голодными по фосфору.
Подготовленный посевной материал использовали для засева опытных колб с концентрацией МФК (метилфосфонатов) 0,3 г/л. Рост культур контролировали по изменению оптической плотности и контролировали изменение содержания органического фосфора и значение рН. По данным измерений оптической плотности и концентрации загрязнителя строили кривые роста культур и потребления источника фосфора (рисунок 7 и 8).
![]()
|
|
|
|
|
|
|
|
