Роль свободных радикалов в природной среде
Были обнаружены значительные расхождения в действии ![]() , на свету и в темноте (см. рис. 2.2). Как известно, световое излучение ускоряет разложение перекисных соединений. Особенности изменения рН на кривой 5 можно объяснить особенностями гетерогенного окисления перекисью водорода коллоидной органики.
, на свету и в темноте (см. рис. 2.2). Как известно, световое излучение ускоряет разложение перекисных соединений. Особенности изменения рН на кривой 5 можно объяснить особенностями гетерогенного окисления перекисью водорода коллоидной органики.
2.3 Анализ результатов
Предположительно, источником подщелачивания являлись окислительно-восстановительные реакции с участием перекиси водорода. Разложение перекиси водорода в водных растворах происходит непрерывно под влиянием разнообразных физико-химических воздействий: тепла, света, кавитации и т.п. Восстановление ![]() может происходить либо через диссоциацию с образованием гидроксил-иона и гидроксильного радикала, либо через протонирование и распад на воду и гидроксильный радикал.
может происходить либо через диссоциацию с образованием гидроксил-иона и гидроксильного радикала, либо через протонирование и распад на воду и гидроксильный радикал.
Известно, что гидроксильный радикал является самым реакционноспособным окислителем в природной среде и способен реагировать практически со всеми растворенными в воде органическими и неорганическими веществами. Основные пути превращения гидроксильных радикалов в водных растворах — это отрыв водорода от органических соединений с образованием воды и органического радикала, гидроксилирование ненасыщенных органических соединений и реакции одноэлектронного переноса с анионами. В результате подобных радикальных перегруппировок образуются более стабильные и долгоживущие радикалы. Рекомбинация углеродсодержащих радикалов приводит в конечном итоге к появлению органических соединений, и это служило причиной образования осадка в проводившихся опытах. Образование подобного осадка рыжевато-коричневого цвета имело место как в чистых растворах гидрокарбонатов, так и в водопроводной воде при длительном отстаивании.
В речной воде образующийся осадок, как правило, более темный, что связано с включением в процессы радикальных превращений фрагментов гумусовых соединений, присутствующих в значительных количествах в природных водах.
Если в водных растворах преобладают карбонаты и гидрокарбонаты, то восстановление гидроксильных радикалов наиболее вероятно по следующей схеме:
![]()
Лимитирующим фактором реакции (1) является активность гидроксильных радикалов, концентрация которых в природных водах составляет ![]() моль/л. В случае добавления перекиси водорода концентрация гидроксил-ионов должна увеличиться, и эффект подщелачивания в результате реакции (1) станет более заметным. Факторы, ускоряющие процесс разложения
моль/л. В случае добавления перекиси водорода концентрация гидроксил-ионов должна увеличиться, и эффект подщелачивания в результате реакции (1) станет более заметным. Факторы, ускоряющие процесс разложения ![]() , в том числе солнечный свет, должны усиливать подщелачивание. Именно такое поведение растворов и наблюдалось в проводившихся опытах (см. кривые 1, 4, 5).
, в том числе солнечный свет, должны усиливать подщелачивание. Именно такое поведение растворов и наблюдалось в проводившихся опытах (см. кривые 1, 4, 5).
В качестве восстановителей и одновременно катализаторов процесса могут выступать металлы переменной валентности, в том числе железо (общая концентрация ионов железа в речной воде составляет 0,2-1,2 мг/л). Полная схема катализа ионами железа распада перекиси водорода представлена ниже. Логарифмы скоростей реакций приведены для температуры 298 К.
свободный радикал стратосфера тропосфера
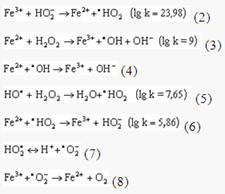
В растворе без доступа света преобладают наиболее быстрые реакции (2) и (3), что и является причиной подщелачивания среды (см. кривую 5). Под действием света происходит фотодиссоциация перекиси водорода, концентрация гидроксильных и гидроперекисных радикалов возрастает — и начинает заметно сказываться влияние реакций (4)-(6), что существенно ускоряет ход процесса (см. кривую 4). Реакции (7), (8), способствующие подкислению среды, по-видимому, являются второстепенными, хотя с повышением рН их роль может усиливаться.
Окислительно-восстановительные системы подобной структуры помимо переходных металлов образуют и органические соединения, в частности гидрохинон. Установлено, что гидрохинон является экзометаболитом некоторых видов бактерий, так что его присутствие в речной воде и участие в процессах каталитического разложения ![]() вполне закономерно.
вполне закономерно.
Генерация свободных радикалов в природных водах может происходить и без участия перекиси водорода. Причем в роли инициаторов могут активно выступать органические соединения, характерные для речной воды. Такие процессы происходят в гумусовых веществах в результате фотовозбуждения карбонильных групп до так называемых n- p-триплетных состояний. Возможен и вариант фотоэлектронного переноса, когда супероксид-ион образуется непосредственно из растворенного в воде кислорода. Подобные реакции часто осуществляются в молекулах красителей и фульвокислот.
Реальна также и непосредственная активация молекулярного кислорода ионами металлов переменной валентности, возбужденных солнечным светом. Образующиеся металл-кислородные комплексы распадаются с выделением либо гидропероксид-иона, либо супероксид-иона.
Металлы в природных водах присутствуют либо в форме комплексов с водными органическими соединениями, либо в коллоидной форме гидроокисей. Перенос электрона при взаимодействиях ионов металлов с ![]() осуществляется через образование промежуточных металл-перекисных комплексов. Такие комплексы образуются при наличии одного или двух вакантных мест в координационной сфере иона металла. Соответствующие изменения геометрической структуры координационной сферы или числа лигандов могут происходить без больших затрат энергии извне даже для самых прочных координационных связей. Каталитическая активность проявляется, таким образом, для ионов металлов и в комплексной, и в коллоидной форме. Вторичные реакции образующегося супероксид-иона могут приводить как к образованию гидроксил-иона, так и к выделению кислорода. Предполагается, что они и являются причиной подщелачивания в изолированной речной воде (см. кривую 1 на рис.2.1.).
осуществляется через образование промежуточных металл-перекисных комплексов. Такие комплексы образуются при наличии одного или двух вакантных мест в координационной сфере иона металла. Соответствующие изменения геометрической структуры координационной сферы или числа лигандов могут происходить без больших затрат энергии извне даже для самых прочных координационных связей. Каталитическая активность проявляется, таким образом, для ионов металлов и в комплексной, и в коллоидной форме. Вторичные реакции образующегося супероксид-иона могут приводить как к образованию гидроксил-иона, так и к выделению кислорода. Предполагается, что они и являются причиной подщелачивания в изолированной речной воде (см. кривую 1 на рис.2.1.).
Деятельность микроорганизмов в водной среде не приводит к значительным разрушениям водных органических соединений. В противном случае это сопровождалось бы понижением рН в речной воде. По этой же причине биохимические превращения гидрокарбонат-ионов незначительны. Эффект увеличения рН в модельных растворах легко можно было бы объяснить выделением части углекислоты в атмосферу в ходе установления равновесия (при рН < 8,35 в водных растворах всегда содержится определенное количество свободных молекул ![]() ):
):
![]()
Именно такое объяснение наиболее приемлемо для чистых растворов гидрокарбонатов (см. кривую 6). Однако сходство поведения речной воды и гидрокарбонатных модельных растворов с добавлением ![]() свидетельствует об участии растворенной углекислоты в окислительно-восстановительных процессах (см. кривую 7). Удаление из раствора углекислоты (через кипячение) при наличии высокой активности гидроксорадикалов приводит к быстрой стабилизации рН (см. кривую 3). Отсюда можно предположить, что гидрокарбонат-ионы играют роль своеобразного аккумулятора свободных радикалов, существенно замедляя дальнейшие радикальные реакции. Конкретный механизм участия гидрокарбонатов в окислительно-восстановительных реакциях требует проверки в ходе дальнейших исследований. [3]
свидетельствует об участии растворенной углекислоты в окислительно-восстановительных процессах (см. кривую 7). Удаление из раствора углекислоты (через кипячение) при наличии высокой активности гидроксорадикалов приводит к быстрой стабилизации рН (см. кривую 3). Отсюда можно предположить, что гидрокарбонат-ионы играют роль своеобразного аккумулятора свободных радикалов, существенно замедляя дальнейшие радикальные реакции. Конкретный механизм участия гидрокарбонатов в окислительно-восстановительных реакциях требует проверки в ходе дальнейших исследований. [3]
