Свойства азота
Таблица 3. НЕКОТОРЫЕ ФИЗИЧЕСКИЕ СВОЙСТВА АММИАКА И ВОДЫ
|
Свойство |
Аммиак |
Вода |
|
Плотность, г/см3 |
0,65 (–10° С) |
1,00 (4,0° С) |
|
Температура плавления, °С |
–77,7 |
0 |
|
Температура кипения, °С |
–33,35 |
100 |
|
Критическая температура, °С |
132 |
374 |
|
Критическое давление, атм |
112 |
218 |
|
Энтальпия испарения, Дж/г |
1368 (–33° С) |
2264 (100° С) |
|
Энтальпия плавления, Дж/г |
351 (–77° С) |
334 (0° С) |
|
Удельная электропроводность |
5Ч10–11 (–33° С) |
4Ч10–8 (18° С) |
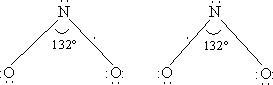
Температуры кипения и плавления у аммиака намного ниже, чем у воды, несмотря на близость молекулярных масс и сходство строения молекул. Это объясняется относительно большей прочностью межмолекулярных связей у воды, чем у аммиака (такая межмолекулярная связь называется водородной).
Аммиак как растворитель
Высокая диэлектрическая проницаемость и дипольный момент жидкого аммиака позволяют использовать его как растворитель для полярных или ионных неорганических веществ. Аммиак-растворитель занимает промежуточное положение между водой и органическими растворителями типа этилового спирта. Щелочные и щелочноземельные металлы растворяются в аммиаке, образуя темносиние растворы. Можно полагать, что в растворе происходит сольватация и ионизация валентных электронов по схеме:
![]()
Синий цвет связывают с сольватацией и движением электронов или с подвижностью «дырок» в жидкости. При высокой концентрации натрия в жидком аммиаке раствор принимает бронзовую окраску и отличается высокой электропроводностью. Несвязанный щелочной металл можно выделить из такого раствора испарением аммиака или добавлением хлорида натрия. Растворы металлов в аммиаке являются хорошими восстановителями. В жидком аммиаке происходит автоионизация
![]()
аналогично процессу, протекающему в воде:
![]()
Жидкий аммиак как растворитель имеет преимущество в некоторых случаях, когда невозможно проводить реакции в воде из-за быстрого взаимодействия компонентов с водой (например, окисление и восстановление). Например, в жидком аммиаке кальций реагирует с KCl с образованием CaCl2 и K, поскольку CaCl2 нерастворим в жидком аммиаке, а К растворим, и реакция протекает полностью. В воде такая реакция невозможна из-за быстрого взаимодействия Ca с водой [8,10].
Получение аммиака
Газообразный NH3 выделяется из солей аммония при действии сильного основания, например, NaOH:
![]()
Метод применим в лабораторных условиях. Небольшие производства аммиака основаны также на гидролизе нитридов, например Mg3N2, водой. Цианамид кальция CaCN2 при взаимодействии с водой также образует аммиак. Основным промышленным методом получения аммиака является каталитический синтез его из атмосферного азота и водорода при высоких температуре и давлении:
![]()
Водород для этого синтеза получают термическим крекингом углеводородов, действием паров воды на уголь или железо, разложением спиртов парами воды или электролизом воды. На синтез аммиака получено множество патентов, отличающихся условиями проведения процесса (температура, давление, катализатор). Существует способ промышленного получения при термической перегонке угля. С технологической разработкой синтеза аммиака связаны имена Ф.Габера и К.Боша [8,9,10].
Оксиды азота
В соединениях с кислородом азот проявляет все степени окисления, образуя оксиды: N2O, NO, N2O3, NO2 (N2O4), N2O5. Имеется скудная информация об образовании пероксидов азота (NO3, NO4).
Оксид азота(I) N2O (монооксид диазота) получается при термической диссоциации нитрата аммония:
![]()
Молекула имеет линейное строение
![]()
N2O довольно инертен при комнатной температуре, но при высоких температурах может поддерживать горение легко окисляющихся материалов. N2O, известный как «веселящий газ», используют для умеренной анестезии в медицине.
Оксид азота(II) NO – бесцветный газ, является одним из продуктов каталитической термической диссоциации аммиака в присутствии кислорода:
NO образуется также при термическом разложении азотной кислоты или при реакции меди с разбавленной азотной кислотой:
![]()
NO можно получать синтезом из простых веществ (N2 и O2) при очень высоких температурах, например в электрическом разряде. В структуре молекулы NO имеется один неспаренный электрон. Соединения с такой структурой взаимодействуют с электрическим и магнитным полями. В жидком или твердом состоянии оксид имеет голубую окраску, поскольку неспаренный электрон вызывает частичную ассоциацию в жидком состоянии и слабую димеризацию в твердом состоянии: 2NO N2O2.
Оксид азота(III) N2O3 (триоксид азота) – ангидрид азотистой кислоты:
N2O3 + H2O = 2HNO2.
Чистый N2O3 может быть получен в виде голубой жидкости при низких температурах (–20° С) из эквимолекулярной смеси NO и NO2. N2O3 устойчив только в твердом состоянии при низких температурах (т.пл. –102,3° С), в жидком и газообразном состояния он снова разлагается на NO и NO2.
Оксид азота(IV) NO2 (диоксид азота) также имеет в молекуле неспаренный электрон (см. выше оксид азота(II)). В строении молекулы предполагается трехэлектронная связь, и молекула проявляет свойства свободного радикала (одна линия соответствует двум спаренным электронам)