Свойства азота
NO2 получается каталитическим окислением аммиака в избытке кислорода или окислением NO на воздухе:
![]()
а также по реакциям:
![]()
При комнатной температуре NO2 – газ темнокоричневого цвета, обладает магнитными свойствами благодаря наличию неспаренного электрона. При температурах ниже 0° C молекула NO2 димеризуется в тетраоксид диазота, причем при –9,3° C димеризация протекает полностью: 2NO2 N2O4. В жидком состоянии недимеризовано только 1% NO2, а при 100° C остается в виде димера 10% N2O4.
NO2 (или N2O4) реагирует в теплой воде с образованием азотной кислоты: 3NO2 + H2O = 2HNO3 + NO. Технология NO2 поэтому очень существенна как промежуточная стадия получения промышленно важного продукта – азотной кислоты.
Оксид азота(V) N2O5 (устар. ангидрид азотной кислоты) – белое кристаллическое вещество, получается обезвоживанием азотной кислоты в присутствии оксида фосфора P4O10:
![]()
N2O5 легко растворяется во влаге воздуха, вновь образуя HNO3. Свойства N2O5 определяются равновесием
![]()
N2O5 – хороший окислитель, легко реагирует, иногда бурно, с металлами и органическими соединениями и в чистом состоянии при нагреве взрывается. Вероятную структуру N2O5 можно представить как
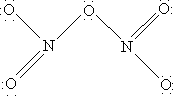
Оксокислоты азота. Для азота известны три оксокислоты: гипоазотистая H2N2O2, азотистая HNO2 и азотная HNO3.
Гипоазотистая кислота H2N2O2 – очень нестабильное соединение, образуется в неводной среде из соли тяжелого металла – гипонитрита при действии другой кислоты: M2N2O2 + 2HX 2MX + H2N2O2. При выпаривании раствора образуется белое взрывчатое вещество с предполагаемой структурой H–O–N=N–O–H.
Азотистая кислота HNO2 не существует в чистом виде, однако водные растворы ее невысокой концентрации образуются при добавлении серной кислоты к нитриту бария:
![]()
Азотистая кислота образуется также при растворении эквимолярной смеси NO и NO2 (или N2O3) в воде. Азотистая кислота немного сильнее уксусной кислоты. Степень окисления азота в ней +3 (ее структура H–O–N=O), т.е. она может являться и окислителем, и восстановителем. Под действием восстановителей она восстанавливается обычно до NO, а при взаимодействии с окислителями окисляется до азотной кислоты.
Скорость растворения некоторых веществ, например металлов или иодид-иона, в азотной кислоте зависит от концентрации азотистой кислоты, присутствующей в виде примеси. Соли азотистой кислоты – нитриты – хорошо растворяются в воде, кроме нитрита серебра. NaNO2 применяется в производстве красителей [15,9,14].
Получение и применение азота
В лаборатории азот легко может быть получен при нагревании концентрированного нитрита аммония:
NH4NO2 = N2 + 2H2
В лаборатории чистый («химический») азот получают добавляя при нагревании насыщенный раствор хлорида аммония NH4Cl к твердому нитриту натрия NaNO2 при нагревании:
NaNO2 + NH4Cl = NaCl + N2 + 2H2O
O. Технический способ получения азота основан на разделении предварительно сжиженного воздуха, который затем подвергается разгонке. Для этого воздух сначала охлаждают, сжижают, а жидкий воздух подвергают перегонке (дистилляции). Температура кипения азота немного ниже (–195,8°C), чем другого компонента воздуха — кислорода (–182,9°C), поэтому при осторожном нагревании жидкого воздуха азот испаряется первым. Потребителям газообразный азот поставляют в сжатом виде (150 атм. или 15 МПа) в черных баллонах, имеющих желтую надпись «азот».
Основная часть добываемого свободного азота используется для промышленного производства аммиака, который затем в значительных количествах перерабатывается на азотную кислоту, удобрения, взрывчатые вещества и т. д. Помимо прямого синтеза аммиака из элементов, промышленное значение для связывания азота воздуха имеет разработанный в 1905 цианамидный метод, основанный на том, что при 10000С карбид кальция (получаемый накаливанием смеси известии угля в электрической печи) реагирует со свободным азотом:
CaC2 + N2= CaCN2 + C
Образующийся цианамид кальция при действии перегретого водяного пара разлагается с выделением аммиака:
CaCN2 + 3H2O = CaCO3 + 2NH3.
Cвободный азот применяют во многих отраслях промышленности: как инертную среду при разнообразных химических и металлургических процессах, для заполнения свободного пространства в ртутных термометрах, при перекачке горючих жидкостей и т. д. Жидкий азот находит применение в различных холодильных установках. Его хранят и транспортируют в стальных сосудах Дьюара, газообразный азот в сжатом виде - в баллонах. Широко применяют многие соединения азота. Производство связанного азота стало усиленно развиваться после 1-й мировой войны и сейчас достигло огромных масштабов [14].
Экспериментальная часть. Получение азота разложением нитрита аммония
Азот в лаборатории получают при взаимодействии насыщенных растворов хлорида аммония и нитрита калия. Образующийся в результате реакции обмена нитрит аммония легко разлагается с образованием азота и воды.
Оборудование: колба Вюрца, делительная воронка, газоотводная трубка, лучина, цилиндр стеклянный, кристаллизатор, стеклянная пластина, горелка, штатив.
Техника безопасности. Соблюдать правила работы с нагревательными приборами.
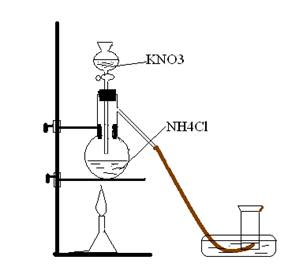
Эксперимент: В колбу Вюрца нальем раствор хлорида аммония 20 мл, а капельную воронку раствор нитрита калия. При приливании нитрита калия, через капельную лейку в колбу начинается выделение азота. Сначала реакция идет медленно, затем ускоряется. Необходимо подогреть колбу с хлоридом аммония, если реакция проходит недостаточно быстро.
KNO2 + NH4Cl = KCl + NH4NO2
NH4NO2 = N2 + 2H2O
Соберем выделяющийся азот в цилиндр. Собирать необходимо таким образом: заполненный водой цилиндр перевернуть дном вверх и поставить в кристаллизатор с водой и внести туда газоотводную трубку. Это бесцветный газ, малорастворимый в воде. Горящая лучинка в атмосфере азота гаснет. Оставим цилиндр открытым, через некоторое время опять внесем зажженную лучинку в цилиндр. Лучинка продолжает гореть. Азот улетучился из цилиндра. Азот немного легче воздуха.
А также при сбалтывании известняковой воды в цилиндре с азотом осадок не образовывается, в отличии от взбалтывания с диоксидом углерода.
N2+Ca(OH)2≠ осадок
Ca(OH)2 + CO2=CaCO3↓+H2O
Вывод: В результате проведенного синтеза получила азот, что подтвердила опытами [17].
Вывод
Азот очень важный и интересный элемент не только для химии, но и для человечетва в общем. В большой части азот находится в природе в свободном состоянии. Имеет 2 стабильных изотопа. Его молекула очень стойкая и мало реакционноспособная, лишь при очень высоких температурах она вступает в реакцию с различными металлами и неметаллами. Найдена некоторая схожесть атома азот с атомом карбона.
