Свойства краун-эфиров и фуллеренов
В 1992 в природном углеродном минерале – шунгите (от названия поселка Шуньга в Карелии) были обнаружены природные фуллерены.
В 1997 Р.Е. Смолли, Р.Ф. Керл, Г. Крото получили Нобелевскую премию по химии за изучение молекул С60[11].
1.2.2 Строение фуллеренов
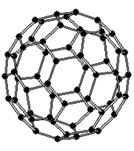
Рис.4.Структура молекулы фуллерена С60.
Центральное место среди фуллеренов занимает С60 (рис. 4.), который характеризуется наиболее высокой симметрией и, как следствие, наибольшей стабильностью. В этой молекуле, напоминающей покрышку футбольного мяча, и имеющей структуру правильного усеченного икосаэдра атомы углерода располагаются на сферической поверхности в вершинах 20 правильных шестиугольников и 12 правильных пятиугольников. Так что каждый шестиугольник граничит с тремя шестиугольниками и тремя пятиугольниками, а каждый пятиугольник - с пятью шестиугольниками. Эта фигура высокосимметричная: у нее существует шесть осей пятого порядка, проходящих через двенадцать противоположно лежащих попарно пятиугольников, десять осей третьего порядка, проходящих через двадцать противоположно лежащих шестиугольников, 30 осей второго порядка, проходящие через противоположно лежащие шестьдесят ребер шестиугольник-шестиугольник, 30 осей второго порядка, проходящие через все противоположные шестьдесят вершин фигуры. Существует также несколько типов плоскостей симметрии пятого, третьего и второго порядков[8].
Электронная оболочка s2p2 атома углерода обеспечивает оптимальную структуру углерода, когда соседние атомы образуют пяти и шестиугольники. Эта структура является оптимальной и для наиболее устойчивых кластеров углерода, образующихся в результате термического распыления графита. Поскольку наиболее эффективные способы получения фуллеренов основаны на термическом разрушении графита, естественно заключить, что шестиугольники, имеют те же размеры, что и шестиугольники, входящие в графит [25].
Графит состоит из слоев, которые выложены правильными шестиугольниками со стороной 0.140 нм, и разделены расстоянием 0.335 нм, атомы соседних слоев расположены не друг под другом, а смещены на половину постоянной решетки. Таким образом, радиус молекулы С60 равен 0.35 нм [22].
В структуре С60 имеются два типа связей: двойная (является общей стороной двух шестиугольников) и одинарная (является общей стороной шестиугольника и пятиугольника). Результаты различных экспериментов показывают, что длины этих связей соответственно равны 0.139 ± 0.001 и 0.144 ± 0.001 нм. Поэтому шестиугольники, составляющие С60, несколько отличаются от правильных и представленная выше оценка размера фуллерена справедлива с точностью 1-2%. Более точное значение радиуса молекулы С60, согласно данным рентгеноструктурного анализа составляет 0.357 нм. [13].
Большинство всевозможных низших и не совсем высших (примерно до ста углеродных атомов) уже зафиксировано экспериментально. Как правило, такие структуры обладают более низкими по отношению к С60 симметриями.
Характеристики фуллерена С60:
1. Мелкокристаллический порошок черного цвета, лишенный запаха.
2. Плотность фуллерена С60 – 1,65 г/см3, что значительно меньше, чем у графита (2,3 г/см3) и алмаза (3,5 г/см3). Это связано с тем, что молекулы полые[22].
3. Практически нерастворимы в полярных растворителях (вода, этанол, ацетон); хорошо растворимы в бензоле, толуоле, фенилхлориде [13].
4. Длины углеродных связей в молекуле составляют 0,143 и 0,139 нм, а диаметр внутренней полости составляет 0,714 нм, что благоприятствует включению в полость другого атома или молекулы – "гостя"[8].
5. С60 сохраняет свою термическую стабильность вплоть до 1700К[16].
6. Модуль объемного сжатия отдельной молекулы теоретически составляет 720-900 ГПа [16].
7. Энтальпия образования С60 составляет ≈ 42.5 кДж/моль (для сравнения: энтальпия образования графита - 0 кДж/моль и алмаза - 1.67кДж/моль)[11].
1.2.3 Свойства фуллеренов
Взаимодействие между атомами разных фуллеренов слабее, чем между ближайшими атомами одного фуллерена. Это означает, что взаимодействие двух молекул фуллерена не приведет к их слипанию, как в случае взаимодействия двух кластеров с пространственным расположением атомов. В этом случае образуется система двух слабо взаимодействующих молекул фуллерена, где каждая молекула фуллерена сохраняет свою индивидуальность [25].
Кристаллические фуллерены и пленки из них представляют собой полупроводники с шириной запрещенной зоны 1.2 - 1.9 эВ и обладают фотопроводимостью при оптическом облучении. Фуллерены в кристаллах характеризуются относительно невысокими энергиями связи, поэтому в таких кристаллах уже при комнатной температуре наблюдаются фазовые переходы, приводящему к ориентационному разупорядочению и размораживанию вращения молекул фуллеренов. Кристаллы С60, легированные атомами щелочных металлов обладают металлической проводимостью, и переходят в сверхпроводящее состояние в диапазоне от 19 до 55К в зависимости от типа щелочного металла. Указанный диапазон температуры сверхпроводящего перехода является рекордным для молекулярных сверхпроводников. Еще более высокая температура сверхпроводящего перехода (вплоть до 100К) ожидается для сверхпроводников на основе высших фуллеренов [11].
Молекулы фуллеренов, в которых атомы углерода связаны между собой как одинарными, так и двойными связями, являются трехмерными аналогами ароматических структур. Обладая высокой электроотрицательностью (они способны накачивать на сферу до 6 дополнительных электронов!), они выступают в химических реакциях как достаточно сильные окислители. Присоединяя к себе радикалы различной химической природы, фуллерены способны образовывать широкий класс химических соединений, обладающих различными физико-химическими свойствами. Так, были получены пленки полифуллерита, в которых молекулы С60 уже связаны не слабыми Ван-дер-ваальсовыми связями, а химическим взаимодействием. Эти пленки, обладающие пластическими свойствами, являются новым типом полимерных материалов[8].
По ряду устных свидетельств, под давлением были синтезированы и объемно-прошитые ковалентными связями образцы фуллеренов. Утверждается, что такой материал царапает алмаз. Если это так, то это свойство вполне понятно. Дело в том, что среднее расстояние углерод-углерод в фуллерене (как было описано в п.1.2.1) равно 0.140 нм, как и в графите, тогда как в алмазе - 0.142 нм. Т.е., в фуллерене химическая связь углерод-углерод сильнее, нежели чем в алмазе. Если решетку из молекул фуллерена прошить объемными сильными ковалентными связями, то способность подобного соединения царапать алмаз становится вполне понятной[11].
Присоединение к С60 радикалов, содержащих металлы платиновой группы, позволяет получить ферромагнитный материал на основе фуллерена. Новые химические свойства обнаруживают соединения, структура которых получается в результате замены части атомов углерода на металлы. К таким соединениям, называемым металлокарбонами, относятся, например, Ti8C12, V8C12, Hf8C12, Zr8C12[11].
