Свойства титана и его соединений
Ti4++2SO42-+2Ba2++4Cl-=2BaSO4+Ti4++4Cl-
Происходит полно и ион Ti4+ не изменяется. Кристаллизация солей с четко выраженными стехиометрическими отношениями также является доказательством их ионной природы.
В водных сернокислых растворах существование ионов Ti4+ невозможно, так как Ti существует в виде гидратных комплексов Ti(H2O)64+, подвергающихся гидролизу с депротонизацией. С позиций представлений о льдоподобной структуре воды выполненные расчеты по данным кажущихся мольных объемов позволяют предполагать нахождение Ti(H2O)64+ как в каркасе структуры воды, так и в ее пустотах.
Прямых доказательств существования ионов титанила TiO2+ в растворе нет. Однако наличие TiO-группы в ряде соединений не вызывает сомнения. Термохимическим методом показано, что ион титанила обладает в растворе ярко выраженной положительной гидратацией. Гидратные числа, рассчитанные для Ti-форм при мольных соотношениях SO3 : Ti, равных 2 и 1, составляют 9и 5 соответственно, что близко к минимальным величинам для ионов U4+, Na+ и К+, найденным по данным числе переноса электролитов. С ростом концентрации титана гидратные числа уменьшаются и к моменту кристаллизации сульфатов становятся близкими к числу молекул Н2О на атом Ti, прочно связанных в твердой фазе.[6,c.66]
Гидролиз титансодержащих ионов или нейтральных молекул в сернокислых растворах – сложный физико-химический процесс. В нем различают несколько стадий: взаимодействие сульфатов титана с водой с их переходом в основные сульфаты, образование и рост мицелл гидроокиси, коагуляция мицелл с выпадением осадка. Процесс гидролиза сульфатов титана может быть представлен последовательными реакциями:
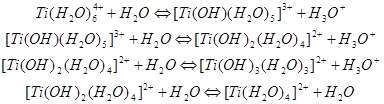
Титановая губка. При металлотермическом восстановлении четыреххлористого титана образуются отдельные кристаллы металла. Размер этих кристаллов колеблется от сотых долей микрона до 10мм и более. В процессе восстановления и при высокотемпературной выдержке отдельные кристаллы срастаются в губчатый блок, сохраняющий размеры и форму реакционного сосуда. Как и всякое пористое тело, титановая губка имеет большую удельную поверхность.
Попадая на воздух, эта поверхность контактирует с газами, входящими в состав воздуха. Титан является химически активным элементом и вступает во взаимодействие с окружающими его газами. Степень этого взаимодействия зависит от величины поверхности губки, характера взаимодействия титана с каждым из газов и температуры.
При дроблении, прессовании и других операциях губка нагревается до 250-300˚С. Это способствует ускорению химического взаимодействия титана с газами. Присутствие хлористых солей в губке делает ее контакт с воздухом более опасным, поскольку хлориды интенсивно поглощают воду. Эти свойства губки при определенных условиях проявляются настолько резко, что из высших сортов металла может быть получено изделие низкого качества или даже брак. Поэтому, явления связанные с загрязнением титановой губки в период ее пребывания на воздухе, требуют тщательного изучения и постоянного внимания.
Взаимодействие титановой губки с кислородом. Титан взаимодействует с кислородом при всех температурах. При избытке кислорода образуется TiO2, в иных условиях возможно образование TiO и Ti2O3. Образовавшийся при комнатной температуре адсорбционный слой состоит из химически связанного кислорода и надстройки слабо связанных с поверхностью атомов газов. В начальный период процесса на скорость роста окисной пленки основное влияние оказывает температура. Окисление поверхности титана происходит главным образом в течение 1-2 ч. Дальнейшая выдержка при температурах до 300˚С приводит к незначительному изменению состояния поверхности. Это связано с защитными свойствами окисной пленки.
Процесс окисления титана на воздухе в интервале 20-300˚С можно разделить на три периода:
1. Образование окисной пленки при температуре до 50˚С; при этом увеличения содержания кислорода методом вакуум-плавления не обнаруживается.
2. Окисление титана в диапазоне температур от 60 до 140˚С; в этом интервале температур увеличение содержания кислорода подчиняется линейному уравнению
![]()
3. Окисление титана в диапазоне температур от 140 до 300˚С; в этом интервале температур увеличение содержания кислорода в титане выражается параболической зависимостью
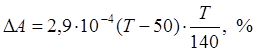
При температурах выше 400˚С структура пленки нарушается, и скорость окисления титана резко возрастает. Это связано с увеличением скорости диффузии ионов кислорода с поверхности в глубь металла. Окисление титана на воздухе протекает более интенсивно, чем в чистом кислороде. Это связано с присутствием азота, который способствует образованию дефектов в решетке окисла и повышает скорость окисления.
Взаимодействие титана с азотом. В результате взаимодействия титана с азотом образуется нитрид титана (TiN). Цвет нитрида титана изменяется от светло-коричневого до бронзово-желтого.
На воздухе до 300˚С титан незначительно взаимодействует с азотом. Этот факт подтверждает, что на воздухе прежде всего образуется окисная пленка, которая в значительной степени защищает титан от взаимодействия с азотом. При повышении температуры до 400˚С начинается некоторое растворение окисной пленки в глубь металла, происходит нарушение структуры поверхностной пленки, в результате чего взаимодействие титана с азотом воздуха интенсифицируется.
В среде азота взаимодействие титана с азотом при 20˚С обнаруживается только по изменению цвета поверхности металла.
Азот способен растворяться в титане; до 550˚С диффузия ионов азота в глубь металла протекает медленно, но резко активизируется при 700˚С. Даже незначительное содержание азота в титане приводит к заметному увеличению его твердости. Азотирование является эффективным средством повышения износоустойчивости титана.
Взаимодействие титана с водой. При химическом взаимодействии титана с водой по схеме
![]()
Протекают одновременно два процесс: поглощение титаном водорода и образование окисных соединений.
Увеличение содержания кислорода в титановой губке при окислении в воде при температуре до 100˚С пропорционально квадрату температуры
![]()
Окисление титана в воде протекает интенсивно; увеличение содержания кислорода в титане в результате взаимодействия с водой более чем в десять раз превышает окисление на воздухе при тех же температурах, содержание водорода в титане после контакта с водой возрастает в 3-4 раза.
Взаимодействие титана с водородом. При взаимодействии титана с водородом образуется гидрид титана (TiH2). Кроме того, титан поглощает около 30% (ат.) водорода, который занимает октаэдрические пустоты решетки. Если адсорбировано незначительное количество водорода, то наблюдается только расширение кристаллической решетки без изменения типа ее структуры. Дальнейшая адсорбция создает значительное напряжение. Более богатой водородом фазе соответствует формула TiH2.
