Синтез ацетилферроцена
СОДЕРЖАНИЕ
1. Введение
2. Литературный обзор
2.1 Строение ферроцена
2.2 Реакции электрофильного замещения ферроцена
2.3 Сравнение электрофильности ферроценов и бензола
2.4 Ацилирование ферроцена
2.5 Окисление ферроценов
3. Экспериментальная часть
3.1. Получение ацетилферроцена
3.2. Разделение ферроцена и ацетилферроцена
4. Обсуждение результатов
4.1. Ацилирование ферроцена
4.2. Сравнение ОВ способностей ферроцена и ацетилферроцена
4.3. Разделение ферроцена и его производных
5. Выводы
6. Литература
1. Введение
Ферроцен (дициклопентадиенилжелезо) - металлорганическое соединение железа с пентагональной антипризматической «сэндвичевой» структурой. Благодаря своему высокосимметричному сэндвичевому строению, ферроцен обладает рядом интересных химических и физических свойств. Это соединение широко применяется в химии, биологии и фармакологии, как в промышленности, так и в научных исследованиях.
Для ферроценов характерны три главных типа превращений: замещение водородов пятичленных колец, окисление по атому железа и разрыв связи железа с циклопентадиенильными кольцами.
Процесс окисления ферроцена по атому железа обратим и протекает без заметных изменений в геометрии катион-радикальной частицы по сравнению с исходной нейтральной молекулой. Однако заместители в циклопентадиенильных кольцах оказывают влияние на окислительно-востановительные способности атома железа: электроноакцепторные заместители резко снижают его окислительную способность.
Сам ферроцен и его производные хорошо растворимы в неполярных растворителях и практически нерастворимы в воде, соли же ферроцений-катиона в воде, напротив, растворяются.
На основе двух вышеуказанных свойств можно предложить простой, но эффективный способ разделения ферроцена и его производных с электроноакцепторными заместителями в циклопентадиенальных кольцах. В данной работе этот метод был использован на примере разделения ферроцена и моноацетилферроцена.
2. Литературный обзор
2.1. Строение ферроцена
Первая публикация о ферроцене появилась в 1951 году, и на сегодняшний день ферроцен - наиболее изученный органический p-комплекс переходного металла. Ферроцен и его производные нашли широкое применение в науке и технике: на их основе синтезируют термостойкие полимерные материалы, они обладают антидетонационной активностью, их применяют для катализа химических реакций, а также используют в биологии и фармакологии (для лечения железодиффецитной анемии). Такая обширность исследований прикладных свойств ферроценов обусловлена их свойствами - необычайно высокой для металлоорганического производного термической стабильностью, низкой токсичностью, способностью обратимо образовывать соединения с различной степенью окисления железа при сохранении молекулярной структуры и богатством химических превращений.
Ферроцен представляет собой оранжевые кристаллы с температурой плавления 173°С и кипения 249°С, плотностью 1.49 г/см3, растворимые в органических растворителях и нерастворимые в воде и возгоняющиеся при атмосферном давлении.
Сэндвичевая структура дициклопентадиенилжелеза была установлена в 1952 году на основании магнитных и спектральных свойств, а так же по рентгеноструктурным данным.
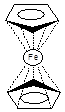
Молекула ферроцена неполярна, дипольный момент её практически равен нулю (0.05 D) и обладает диамагнетическими свойствами. ИК спектры показывают, что в соединении присутствуют С-Н связи только одного типа. Одинаковая ненасыщенность каждого атома углерода в циклопентадиенил-анионе показывает, что две таких частицы могут образовывать симметричные связи с ионом железа [1].
Данные неэмпирических расчётов приводят к распределению зарядов вида Fed+(C5H5)2d- в ферроцене. В зависимости от выбранного метода расчёта величина заряда лежит в пределах d = 0.6¸1.4. Из расчётов получается, что при переходе от ферроцена к ферроцению эффективный заряд на атоме железа меняется менее чем на 0.1, в связи глубокой перестройкой молекулярных орбиталей. Становится понятным хорошо известный для ферроцена экспериментальный факт, что нейтральная молекула и ион имеют практически одну и ту же величину изомерных сдвигов в мёссбауэровских спектрах [2]. Если предположить, что изомерный сдвиг является мерой ковалентности, то ферроцен и его производные относятся к наиболее ковалентным соединениям железа.
В кристалле молекула ферроцена находится в антипризматической заторможенной конформации с точечной группой симметрии D5d. Основные расстояния, найденные при исследовании молекулы в кристалле (в Å): Fe-C 2.000-2.075; C-C 1.40-1.41 [3]. При повышенной температуре и в газовой фазе ферроцен может существовать как в заторможенной, так и в заслонённой конформации, но данные полученные методом дифракции электронов не позволяет сделать выбор между ними. С равным успехом рассматриваются конформации с симметрией D5h и D¥h. Разность энергий D5h и D5d конформаций для ферроцена в газовой фазе оценивается ~1.1ккал/моль. Полагают, что в твёрдом состоянии величина этого барьера тоже невелика и заторможенная конформация в основном стабилизирована взаимодействиями в кристаллической решётке [4].
Долгое время по причине низкого качества кристаллов не удавалось провести достаточно хорошее рентгеноструктурное исследование солей ферроцениевого катиона. По данным исследования с тетрахлорферрат-анионом катион ферроцения в отличие от ферроцена имеет заслонённую конформацию; при этом несколько увеличивается расстояние между плоскостями колец (т.е. растут расстояния Fe-C). Расстояния (в Å) соответственно равны: Fe-C 2.08, C-C 1.40 [5].
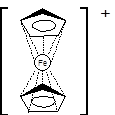
Именно строение ферроцена как высокосимметричного «сэндвича» обуславливает его поразительную стабильность и устойчивость по сравнению с другими металлоорганическими соединениями железа: он выдерживает без разрушения нагревание до температуры 470°С, устойчив к действию воздуха, горячей концентрированной соляной кислоты и 10% водного раствора щёлочи [1].
2.2 Реакции электрофильного замещения ферроцена
При реакции замещения водородов циклопентадиенильных колец и последующих превращениях заместителей не происходит разрыва связей железа с атомами углерода. Нет другого металлоорганического соединения, для которого были бы осуществлены столь многочисленные превращения без разрыва или изменения природы связи углерода с металлом. Ферроценильная группа ведёт себя как устойчивый радикал, переходящий без изменения из соединения в соединение, т.е. так, как представляли себе на заре развития органической химии создатели «теории радикалов».
В молекуле ферроцена имеется два типа нуклеофильных центров – атомы углерода и атом железа. В настоящее время до конца не выяснено, какой из этих нуклеофильных центров является местом первоначальной атаки. Высказано предположение, что при электрофильном замещении в металлоценах существенную роль играет атом металла. Эта идея легла в основу представлений о механизме электрофильного замещения в ферроцене, согласно которым первая стадия замещения представляет собой быстрое обратимое присоединение электрофила к атому железа. На второй, медленной стадии происходит перемещение электрофила в кольцо, приводящее к эндоциклическому s–комплексу, которому авторы приписывают структуру, аналогичную структуре s–комплексов бензольного ряда. На третьей стадии быстро отщепляется протон и образуется замещённый ферроцен [6].
