Синтез ацетилферроцена
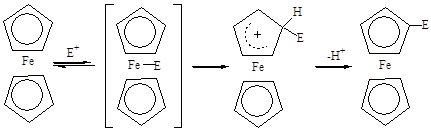
Существенной особенностью предложенного механизма является подход электрофила к пятичленному кольцу со стороны атома железа. Исследование внутримолекулярного ацилирования эпимерной пары кислот, в которых из-за их пространственного строения затруднены в первом случае эндо-, а во втором – экзо-циклическая электрофильная атака, показало, что обе кислоты под действием ангидрида трифторуксусной кислоты циклизуются в гомоциклический кетон, причём скорость циклизации экзо-кислоты несколько больше, чем скорость циклизации эндо-кислоты [7].
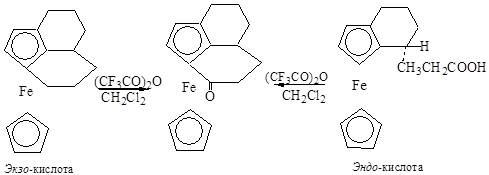
В статьях последних лет предполагается, что жёсткие электрофилы атакуют ферроцен со стороны одного из циклопентадиенальных колец (экзо-атака), а мягкие электрофилы должны сначала образовывать прекомплексы с атомом металла, а затем атаковать пятичленные кольца (эндо-атака) [8].
Водороды С5Н5-колец в мягких условиях замещаются на различные группы. Осуществлено ацилироване, формилирование, алкилирование, сульфирование, диалкил амино метилирование, металлирование и аррилирование ферроцена. Эти реакции идут легче, чем с бензолом. При электрофильном замещении заменяется сначала один водородный атом, а потом второй в другом С5Н5-кольце.
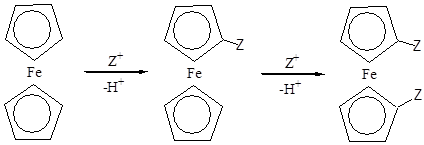
Для перечисленных выше электрофильных реакций (кроме ациллирования), а так же для ариллирования найдены условия при которых с препаративными выходами получаются моно- или гетнроаннулярные дизамещённые ферроцены. Гомоаннулярные производные Z2C5H3FeС5Н5 и тризамещённые Z2C5H3FeС5Н4Z образуются в незначительном количестве.
Разнообразные производные ферроцена получены как путём прямой замены водорода, так и при последующих превращениях заместителей. Эти превращения в основном аналогичны реакциям соединений бензольного ряда.
2.3 Сравнение электрофильности ферроценов и бензола.
Несмеяновым и его сотрудниками было показано, что по общему характеру реакционной способности ферроцен является ярким примером небензоидной ароматической системы [9]. Для того, чтобы охарактеризовать относительную электрофильность этого ряда, они воспользовались простейшей реакцией электрофильного замещения – реакцией изотопного обмена водорода, а также сопоставили константы скорости, полученные для ферроцена и его производных, с константами скорости изотопного обмена водорода производных бензола. Наиболее удобным донором дейтерия оказалась трифтордейтероуксусная кислота, обладающая высокой функцией кислотности (Н0 = -3.03) и являющаяся хорошим растворителем для многих органических веществ. Была изучена кинетика водородного обмена ферроцена, ацетилферроцена, диацетилферроцена и толуола трифтордейтероуксусной кислоте при температуре 25°С, используя в качестве растворителя бензол. В расчёт принимались атомы водорода только углеводородных колец.
Если принять константу скорости водородного обмена толуола за единицу, то исследуемые соединения по их убывающей способности к электрофильному замещению можно расположить в следующем порядке:
Ферроцен > ацетилферроцен > 1,1’-диацетилферроцен > толуол 5333 5.0 2.6 1
Таким образом, способность к реакциям электрофильного замещения у ферроцена оказалась более чем на три порядка выше, чем у толуола. Введение ацетильной группы в ядро ферроцена понижает скорость водородного обмена циклопенпадиенальных колец в 1000 раз по сравнению с незамещённым ферроценом. Бензол в этих условиях в реакцию водородного замещения не вступает.
Поэтому замещение водорода в ферроцене при действии электрофильных реагентов происходит в более мягких условиях, нежели в бензоле.
Влияние заместителей в циклопентадиенальном кольце на замещение других водородов ферроценильной группы аналогично влиянию в бензольном ряду: электроноакцепторные заместители затрудняют реакции электрофильного замещения, а электронодонорные заместители облегчают эти реакции. Однако граница между электронодонорными и электроноакецепторными заместителями иная, чем в бензольном ряду. Это обусловлено большей, чем у бензола, нуклеофильностью ферроцена, а также различиями таутомерного и индуктивного эффектов заместителей в ферроценовом и бензольном ядрах. Правила ориентации при электрофильном замещении менее чётки, чем в бензольном ряду.
2.4 Ацилирование ферроцена
Ацилирование циклопентадиенилжелеза и его производных осуществлено многими реагентами. Первый ацил был синтезирован при взаимодействии ферроцена с ацетилхлоридом в присутствии хлористого алюминия [10]. Эта реакция дала толчок для изучения ароматических свойств данной системы, а также дала ферроцену его название.
При ацилировании ферроцена получают моно- и ди-ацилферроцены в зависимости от соотношения реагентов, характера взятого катализатора и его количества.
Моноацилферроцены получаются при ацилировании ферроцена галогенангидридами или ангидридами карбоновых кислот в присутствии хлористого алюминия. Однако наряду с монокетоном всегда образуется дикетон.
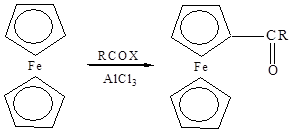
Если хлористый алюминий взят в избытке, то образуется только дикетон даже при эквимольных количествах ферроцена и галогенангидрида. Также при избытке хлорида алюминия (III) ферроцен может протонироваться выделяющимся хлористым водородом и осаждается в виде комплекса, который не ацилируется [11]:
C10H10Fe + AlCl3 + HCl ![]() (C10H11Fe)+( AlCl4)-
(C10H11Fe)+( AlCl4)-
Моноацилирование ферроцена лучше проводить в присутствии более мягких, чем хлористый алюминий, катализаторов (хлорное олово, фосфорная кислота).
Моноацетилферроцен получается при действии на ферроцен силикоангидрида уксусной кислоты и четырёххлористого олова:
![]() 4(C5H5)2Fe + Si(OCOMe)4
4(C5H5)2Fe + Si(OCOMe)4 ![]() 4C5H5FeC5H4COMe + Si(OH)4
4C5H5FeC5H4COMe + Si(OH)4
Уксусный ангидрид ацетилирует ферроцен до моноацетилферроцена в присутствии фосфорной кислоты [12], трёхфтористого бора [13] или MgBr2×Et2O [14].
Описано моноацилирование ферроценаацилхлоридами в присутствии Mo(CO)6 как катализотора [15]:
(C5H5)2Fe + RCOCl ![]() C5H5FeC5H4COR
C5H5FeC5H4COR
Моноацилирование ферроцена - это основной метод синтеза ацилферроценов, являющихся исходными веществами для приготовления разнообразных производных ферроцена.
2.5 Окисление ферроценов
Ферроцен и многие его производные легко окисляются по атому железа, давая соответствующие однозарядные катион-радикальные частицы: ферроцений и замещённые ферроцении. Процесс окисления обратим и протекает без заметных изменений в геометрии катион-радикальной частицы по сравнению с исходной нейтральной молекулой. Спектральные, а также структурные исследования позволяют считать, что как в кристаллах, так и в растворах ионы ферроцения присутствуют как независимые частицы, взаимодействующие с противоионами и молекулами среды на ван-дер-ваальсовых расстояниях. Такое положение не является неожиданным, так как атом железа в системе ферроцен-ферроцений является координационно насыщенным, а электрон при окислении ферроцена в ферроцений удаляется с невсязывающей молекулярной орбитали (преимущественно d-типа).
