Синтез диэтилового эфира малоновой кислоты. Свойства и основные методы получения сложных эфиров
Зависимость температуры плавления от числа атомов углерода в молекулах представляет собой «пилу» с еще более острыми зубцами. Объяснение такое же, как и для монокарбоновых кислот: разное строение кристаллической решетки для четных и нечетных членов ряда. Для первых семи членов ряда наблюдается также сильное альтернирование величин растворимости кислот в воде. Понятно, что это свойство также связано с кристаллической решеткой: чем она прочнее, тем меньше растворимость.
Простейшая двухосновная щавелевая кислота содержит две соединенные карбоксильные группы НООС–СООН. Ее соли и эфиры называются оксалатами (от греч. oxys – кислый). Эта кислота известна с 17 в., она содержится (в виде калиевой соли) в щавеле (ее там 0,36%), откуда и получила свое название. Есть она и в других овощах и плодах: в шпинате ее 0,32%, в томатах – 0,06%. Избыток щавелевой кислоты может нарушать обмен веществ в организме, способствуя отложению нерастворимого оксалата кальция. Поэтому врачи рекомендуют ограничить потребление продуктов с повышенным содержанием этой кислоты.
Щавелевая кислота – одна из самых сильных органических кислот: при диссоциации по первой ступени она значительно сильнее уксусной. Она образует хорошо растворимые комплексные соединения со многими металлами, что используют для очистки металлов от ржавчины, для выведения ржавых пятен с тканей, сантехнических изделий и т.д. Например, ржавое пятно на белой ткани, смоченное раствором щавелевой кислоты, исчезает прямо на глазах.
Диэтиловый эфир малоновой кислоты (от лат. malum – яблоко) широко применяется в органических ситезах; химики называют его просто «малоновым эфиром». От этого же корня происходят названия непредельной малеиновой кислоты (цис-НООС–СН=СН–СООН) и производных яблочной кислоты – малатов. Интересно название транс-изомера малеиновой кислоты – фумаровой (от лат. fumus – дым). Эта кислота была обнаружена в растении Fumaria officinalis (дымянка), которое в античные времена сжигали, чтобы дымом отогнать злых духов.
Янтарная кислота была получена еще в 17 в. перегонкой янтаря, ее соли и эфиры назваются сукцинатами (лат. succinum – янтарь). Глутаровая кислота впервые была получена из глутаминовой аминокислоты, а та получила свое название от лат. gluten – клей, поскольку была найдена в клейковине пшеницы. Адипиновая кислота образуется при окислении жиров и получила название от лат. adeps – жир, сало. Эту кислоту синтезируют в промышленных масштабах, так как она является исходным веществом для производства полиамидных волокон (найлон-6,6) и смол. Кстати, название этого полимера происходит от первых букв двух городов – New York, London и числа атомов углерода в остатках адипиновой кислоты и гексаметилендиамина H2N –(CH2)6 –NH2, которые соединены поочередно в полимерную цепь. Название пимелиновой кислоты происходит от греч. pimelos – жир, субериновой (пробковой) кислоты – от лат. suber – пробка, себациновой кислоты – от лат. sebum – сало. Азелаиновая кислота была получена действием азотной кислоты на касторовое масло. Соответственно в ее названии можно найти «азо» и греч. elaion – масло.
Двухосновные кислоты с числом атомов углерода более 10 имеют обычно систематические названия. Но есть и исключения: брассиловая кислота была найдена в масле растений семейства Brassica; тапсиевая – в растении тапсия с греческого острова Тапсос, которое употреблялось в древности как лекарственное; японовая НООС–(СН2)19–СООН – выделена из высушенного сока некоторых акаций и пальм, растущих в Юго-Восточной Азии (раньше это вещество называли «японской землей»)
2.2. Реакция этерификации
Основным способом получения сложных эфиров карбоновых кислот является реакция этерификации. Диэтилмалеат не является исключением. Этерификация – практически главнейший способ получения данного эфира двухосновной кислоты. Рассмотрим основные свойства реакции этерификации.
Итак, реакцией этерификации называется взаимодействие спиртов с карбоновыми кислотами, приводящее к образованию сложных эфиров:
![]()
В этой реакции молекула спирта выступает в роли нуклеофильного агента, атакующего бедный электронами углеродный атом карбонильной группы.
Реакции этерификации обратимы и, следовательно, ограничены состоянием равновесия. Превращение эквимолекулярных количеств кислоты и спирта в теоретически вычисленное количество сложного эфира по причине обратимости реакции невозможно. В результате реакции образуется некоторое максимальное количество эфира (которое всегда ниже теоретического) и остаются непрореагировавшие спирт и кислота. Например, при нагревании с обратным холодильником эквимолекулярных количеств уксусной кислоты и этилового спирта в реакцию вступает лишь 2/3 г-мол каждого компонента, поэтому максимальный выход эфира в этих условиях составляет лишь 2/3 теоретического, т. е. 66,7%.
![]()
По мере того как кислота и спирт реагируют друг с другом и происходит накопление продуктов их взаимодействия (эфира и воды), скорость обратной реакции, вначале незначительная, возрастает. При этом скорость прямой реакции постепенно уменьшается. Наконец, наступает динамическое равновесие, когда в единицу времени в сложный эфир превращается столько же молекул кислоты и спирта, сколько молекул сложного эфира распадается на кислоту и спирт. Одинаковой скоростью этих противоположно протекающих процессов обусловлен постоянный состав системы. Поскольку скорость бимолекулярной реакции пропорциональна произведению концентраций реагирующих веществ, мы можем для скоростей прямой и обратной реакций написать уравнения:
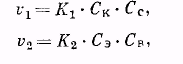
где v1 — скорость реакции этерификации; v2 — скорость реакции гидролиза; К1 и К2 — константы скорости обеих реакций; Ск, Сс, Сэ и Св — концентрации реагирующих и получающихся веществ (кислоты, спирта, эфира, воды).
В состоянии равновесия скорости реакций, протекающих в противоположных направлениях, равны, т. е. V1 = V2. Тогда К1СкСс = КгСэСв или:
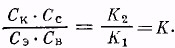
Частное К2/К1 является константой равновесия и обозначается буквой К.
Из полученного уравнения следует, что в состоянии равновесия отношение произведений концентраций реагирующих веществ обратно отношению констант скоростей реакций. В случае реакции образования уксусноэтилового эфира в состоянии равновесия, как упомянуто выше, в реакционной смеси содержится по 1/3 моля кислоты и спирта и по 2/3 моля эфира и воды. Поэтому
![]()
Однако можно изменить состояние равновесия и повысить выход сложного эфира, увеличивая концентрацию спирта (или кислоты). Например, если взять уксусную кислоту и спирт в молярном отношении, равном 1:2, выход эфира (из расчета на кислоту) повышается до 85%. Действительно, пусть концентрация эфира в состоянии равновесия (в молях) будет равна х, т. е. Сэ = х. Тогда и Св = х. Концентрация кислоты Ск = 1—х, концентрация спирта Сс = 2 — х. Следовательно,
