Синтез диэтилового эфира малоновой кислоты. Свойства и основные методы получения сложных эфиров
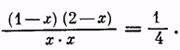
После решения этого уравнения находим, что х = 0,85 моля, то есть выход эфира равен 85% теоретического.
Часто применяется и другой способ смещения равновесия в сторону большего выхода сложного эфира — удаление сложного эфира или воды из сферы реакции. Легко можно видеть, что уменьшение концентраций эфира или воды влечет уменьшение концентраций спирта и кислоты, поскольку величина константы равновесия К при данной температуре неизменна. Так, в случае получения низкокипящих сложных эфиров (например, уксусно-этилового с температурой кипения 77°С) в ходе реакции отгоняют эфир из реакционной колбы. При получении высококипящих сложных эфиров (например, уксуснобутилового с температурой кипения 125°С или уксусноизоамилового с температурой кипения 142°С) удобнее отгонять воду в процессе реакции. Вода в этом случае отгоняется в виде азеотропа с парами соответствующего спирта. При конденсации паров в холодильнике происходит расслоение этих ограниченно смешивающихся жидкостей и вода, как более тяжелая, собирается на дне поставленной на пути конденсата «ловушки» (см. рис. 27). Азеотропную отгонку воды можно использовать и в случае этерификации кислот этиловым или пропиловым спиртом, которые в жидкой фазе смешиваются с водой во всех отношениях. В этом случае для отделения воды от сконденсировавшегося в холодильнике спирта в реакционную смесь приходится добавлять третий компонент, образующий с водой и спиртом нераздельно кипящую смесь, но в жидкой фазе с водой не смешивающийся. Его роль состоит в том, что он экстрагирует из конденсата спирт и возвращает его в реакционный сосуд. В качестве такого компонента могут использоваться бензол, хлороформ, четыреххлористый углерод и некоторые другие жидкости, но из перечисленных только бензол можно использовать в «ловушках». Хлороформ и четыреххлористый углерод обладают большей плотностью, чем вода, и для отделения воды от реакционной смеси в случае использования этих жидкостей требуется «ловушка» другой конструкции.
При комнатной температуре реакция протекает очень медленно. При смешении эквимолярных количеств спирта и кислоты для достижения равновесных концентраций требуется до 16 лет. Повышение температуры ускоряет реакцию (так, в случае взаимодействия этилового спирта с уксусной кислотой при 110°С равновесие достигается через 10 дней, а при (155°С — через несколько часов).
Особенно сильное ускорение реакции этерификации достигается применением катализаторов — водородных ионов, получающихся при диссоциации сильных минеральных кислот. В качестве катализаторов чаще всего используются концентрированная серная кислота или сухой хлористый водород, ток которого пропускается через реакционную смесь. Найдено, что скорость реакции возрастает с увеличением количества катализатора; однако известно также, что добавка 0,01% серной кислоты достаточна для образования этилацетата из спирта и уксусной кислоты. Следует иметь в виду, что катализаторы повышают скорость реакции этерификации, но не могут вызывать сдвига равновесия.
Карбоновые кислоты, как видно из вышесказанного, реагируют со спиртами относительно медленно. Это объясняется слабой активностью карбонильной группы в кислотах по отношению к нуклеофильным агентам по сравнению с активностью той же группы в ангидридах и хлорангидридах кислот, поскольку +М-эффект гидроксильной группы приводит к уменьшению положительного заряда карбонильного углерода
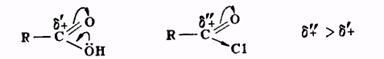
Скорость этерификации карбоновой кислоты тем выше, чем больше положительный заряд карбонильного углерода. Величина δ+ на углероде карбоксильной группы зависит от характера радикала кислоты. Электронодонорные группы, связанные с карбоксилом, понижают дробный положительный заряд (по сравнению с зарядом в муравьиной кислоте) и тем препятствуют взаимодействию кислоты с нуклеофилом; электроноакцепторные заместители, напротив, делают кислоту более реакционноспособной. Поэтому кислоты типа трихлоруксусной, щавелевой, муравьиной быстро реагируют со спиртами даже без добавок минеральной кислоты-катализатора, а ароматические кислоты, особенно те, которые в ароматическом ядре содержат электронодонорные заместители, взаимодействуют со спиртом значительно труднее и требуют больших количеств катализатора.
Сильное влияние на скорость реакции этерификации оказывают также пространственные факторы. С увеличением объема связанных с карбоксилом углеводородных радикалов и с повышением объема этерифицируемых спиртов скорость этерификации уменьшается. Среди спиртов одного молекулярного веса быстрее всего взаимодействуют с кислотами первичные, медленнее — третичные спирты.
Реакцию этерификации можно проводить и в паровой фазе над твердыми катализаторами. Пары спирта и кислоты при 280—300° С пропускают через трубку с катализатором (ThO2 или TiO2). Выходы сложных эфиров в этом случае такие же, как и при реакциях в гомогенной фазе.
Аминокислоты образуют сложные эфиры при взаимодействии со спиртами в присутствии сухого хлористого водорода. Роль хлористого водорода здесь не ограничивается катализом реакции или сдвигом равновесия за счет связывания воды. В присутствии хлористого водорода аминокислота, находившаяся ранее в форме внутренней соли, превращается в хлористоводородную соль аминокислоты, причем карбоксильная группа из неактивной формы аниона переходит в реакционноспособную форму —СООН:
![]()
В результате этерификации в этих условиях эфиры также получаются в виде солей. Например, из аминоуксусной кислоты (гликоколя) и абсолютного этилового спирта образуется хлористоводородная соль эфира гликоколя
![]()
Свободный эфир из соли можно получить, удаляя хлористый водород окисью серебра:
![]()
2.3. Механизм этерификации
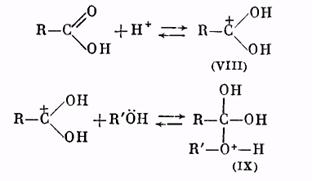
Роль катализатора заключается в протонировании карбонильного кислорода: при этом карбонильный атом углерода становится более положительным и более «уязвимым» по отношению к атаке нуклеофильного агента, которым является молекула спирта. Образующийся вначале катион (VIII) присоединяет молекулу спирта за счет неподеленных электронов кислородного атома, давая катион (IX):
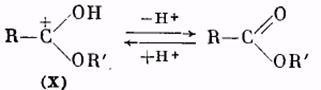
Далее катион (IX) отщепляет молекулу воды, превращаясь в катион сложного эфира (X):
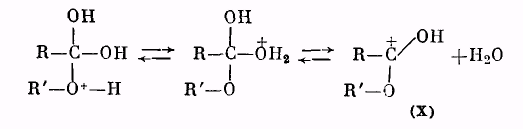
Катион (X) в результате отщепления протона образует молекулу сложного эфира:
Использование метода «меченых атомов» дало возможность решить вопрос о месте разрыва связей при реакции этерификации. Оказалось, что обычно молекула воды образуется из гидроксила кислоты и водорода спирта. Следовательно, в молекуле кислоты разрывается связь между ацилом и гидроксилом, а в молекуле спирта — связь водорода с кислородом. Такой именно вывод следует из результатов работы по этерификации бензойной кислоты метанолом, содержащим тяжелый изотоп кислорода О18. Полученный сложный эфир содержал в своем составе указанный изотоп кислорода:
