Синтез пиррольных интермедиатов для высокосопряженных порфиринов
Другой модификацией этого метода является синтез Смита, заключающийся в конденсации α‑свободных дипиррометанов и ароматического альдегида [60,61]. Возможна конденсация двух молекул пиррометана, содержащего в одном из α‑положений карбонильную группу, при этом получаются зеркальносимметричные порфирины. В последние годы в качестве углеродного фрагмента, соединяющего две молекулы пиррометана, используют не только ароматические альдегиды, но и, например известны синтезы, в которых в конденсацию вводят карбальдегиды ферроцена, выход этих реакций достигает 50% [62]. Порфирины, полученные этим способом, например, мезо-тетракис(1,3-диметилимидазол-2-ил)порфирин и мезо-тетракис(1,2-диметилпиразол-4-ил)порфирин, способны различным путем встраиваться в молекулу ДНК и могут быть использованы в качестве молекулярного транспорта [63].

Смит и сотрудники синтезировали мезоарил-замещенные порфирины, состоящие из двух зеркально‑симметричных фрагментов. Авторами были получены тетраарилпорфирины с различными арильными заместителями по ниже приведенной схеме. 5,15-Ди(4-толил)-10,20-дифенилпорфирин получают данным способом с 31% выходом, а 5,15-бис(4-фторо-3-метилфенил)-10,20-(4-метоксифенил)порфирин – с выходом 24% [60,64].
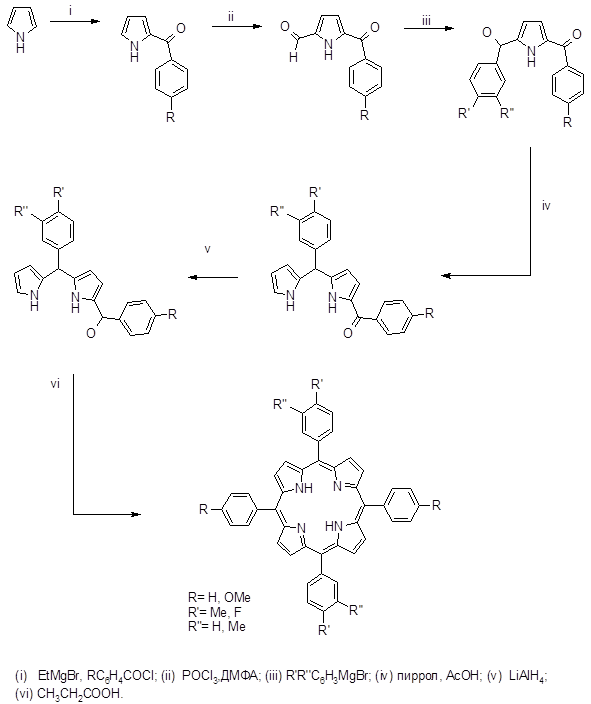
В дипирролилметане (34), имеющем две близкие по реакционной способности группы в положениях 5 и 5’, проводят активацию формильной группы, превращая ее через основание Шиффа (35) в тиоальдегид (36). Конденсация соединений (36) и (37), проводимая в мягких условиях, приводит лишь к одному соединению (38), замыкание и перегруппировка последнего приводят к хлорину (39) с высоким выходом.
2.2.2.1 Синтез порфиринов через b-билены.
В настоящее время известно значительное число методов получения как частично симметричных, так и полностью несимметричных порфиринов через b-билены.
Этот метод достаточно широко используется для синтеза сложных порфиринов, этому способствует ряд обстоятельств: а) более легкий синтез исходных дипирролилметанов по сравнению с получением аналогичных 5,5’-диалкоксикарбонильных соединений, которые необходимы в методе Макдональда; б) отсутствие гексапирродиенов при синтезе биленов; в) возможность получения полностью несимметричных порфиринов. Следует отметить, что при синтезе диацетилпорфирина было показано, что при получении порфиринов с одной и особенно с двумя электроотрицательными группами синтез биленов надо планировать таким образом, чтобы эти заместители находились в крайних пиррольных кольцах. При наличии подобных заместителей в дипирролилметановом фрагменте билена повышалась чувствительность метинового мостика к электрофильным реакциям. Возможность побочных реакций особенно возрастала, когда два таких заместителя расположены в противоположных пиррольных кольцах. С учетом сказанного был синтезирован замещенный цитопорфирин (40), который является ключевым соединением при получении порфирина α, выход составил 30%.
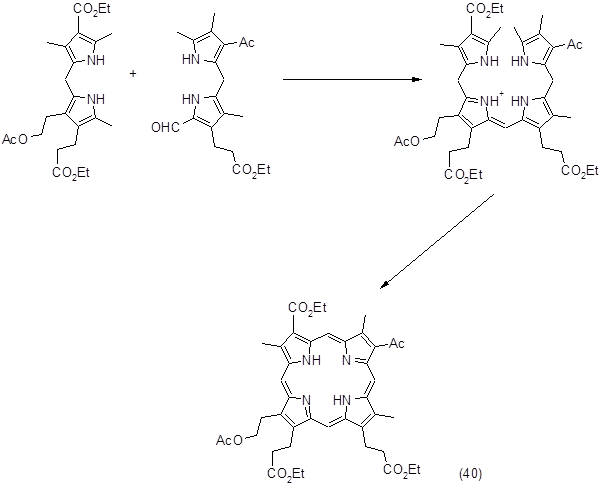
В заключение можно отметить, что использование b‑биленов в качестве промежуточных соединений позволяет получать широкий круг порфиринов с различными заместителями. Среди недостатков этого метода следует отметить недостаточную устойчивость b-биленов и их подверженность нежелательным превращениям.
2.2.2.2. Циклизация а,с-биладиенов.
Биладиены, среди прочих тетрапиррольных структур, играют важную роль в природе (желчные пигменты и протеины) и являются интермедиатами в синтетических подходах к природным порфиринам [65]. В 1966 году Джонсон предложил оригинальный метод синтеза порфиринов, который позволяет получать как симметричные, так и несимметричные порфирины [66].
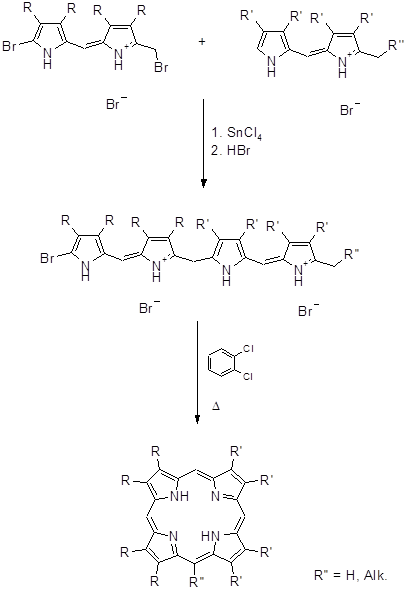
Данный способ нашел применение для алкилзамещенных порфиринов. Выход выше изображенного порфирина на последней стадии составил ~ 70%. На основе а,с- биладиенов также были синтезированы производные мезо-аминопорфирина при аномальной циклизации 1,19-диметил-а,с-диметил-а,с-биладиенов с Cu(OAc)2 в ДМФА, причем мезо-углеродный атом порфиринового макроцикла образуется из карбонильного углерода ДМФА [8,67,68].
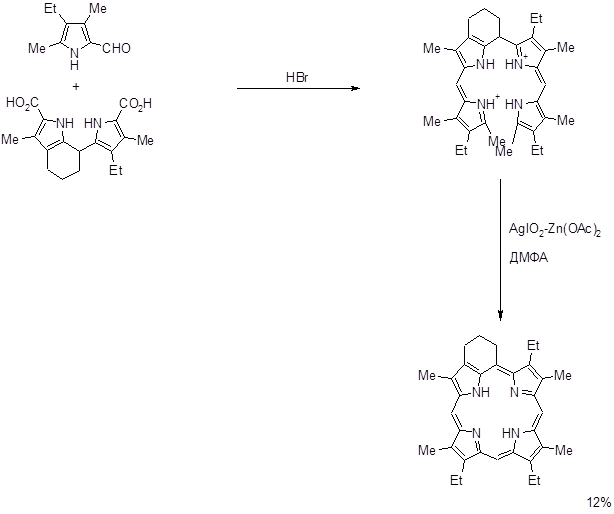
2.2.3. “3+1” порфириновый синтез.
Этот способ позволяет получать как симметричные, так и несимметричные порфирины и их аналоги, причем, выход может достигать отличных для порфиринового синтеза значений ‑ 40-50% [69]. Метод состоит в конденсации трипирана с 2,5‑диформилпирролом [70] или 2,5-бис[(N,N-диметиламино)метил]пирролом [52,71]. Синтез с 2,5‑диформилпирролом используется наиболее часто, его проводят, когда исходные субстраты способны выдержать условия кислотного катализа, либо при однозначном образовании одного изомера порфирина или возможности легкого разделения смеси изомеров. Недостатком выше описанного метода, являлась сложность синтеза 2,5‑диформилпирролов, однако в последние годы был разработан достаточно простой и надежный способ позволяющий получать пиррол дикарбальдегиды с хорошим выходом [6,70,72,73].
Другим возможным вариантом «3+1» порфиринового синтеза является использование 2,5‑бис[(N,N‑диметиламино)метил]пиррола, при этом реакция проводится в более мягких условиях, за счет чего достигается образование одного изомера порфирина, а не всех возможных как при использовании 2,5‑диформилпирролов [52]. При помощи этого метода стало возможным синтезировать азапорфирины, содержащие в качестве одного из пиррольных циклов имидазольный фрагмент, с удовлетворительным выходом [71].

3. Обсуждение результатов.
Порфириновые макроциклы сопряженные по b-положениям пиррольного кольца с ароматическими и гетероциклическими системами нашли применение в качестве молекулярных зондов, высокоэффективных катализаторов, фотосенсоров в фотодинамической терапии рака и красителей поглощающих в ближнем ИК диапазоне спектра. Целью данной работы является поиск подходов к синтезу сопряженной системы пиррола с гетероциклическим фрагментом для последующего введения ее в порфириновый цикл.
Из литературных источников известно, что существует несколько подходов к синтезу порфиринового макроцикла, наиболее часто используемыми являются методы “2+2” и “3+1. Последний метод был выбран как наиболее подходящий. Для его реализации необходимо было синтезировать b-алкил или b-незамещенный трипиран и пиррол, содержащий в b-положениях функциональные заместители. С этой целью был синтезирован трипиран по следующей схеме:
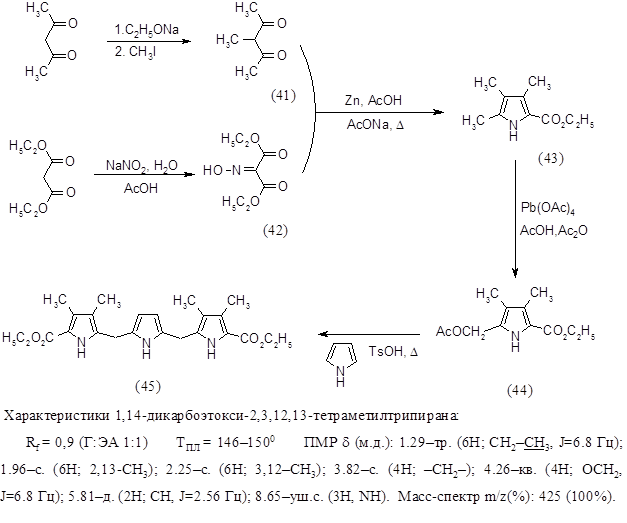
Алкилирование ацетилацетона проводили по стандартной методике - с применением на первой стадии этилата натрия и последующей обработкой метилиодидом при 400 в течение 1 часа, выход 3–метил–2,4–пентандиона (41) составил 48%. Синтез 2‑карбоэтокси-3,4,5‑триметилпиррола (43) проводили из 3-метил-2,4-пентандиона (41) и изонитрозомалонового эфира (42) конденсацией в уксусной кислоте в присутствии цинка и ацетата натрия при нагревании до 900 в течение 1 часа, выход продукта составил 71%. 2‑ацетоксиметил–3,4–диметил–5–карбоэтоксипиррол (44) получали окислением 2‑карбоэтокси-3,4,5-триметилпиррола (43) тетраацетатом свинца в смеси уксусной кислоты и уксусного ангидрида при комнатной температуре в течение 2 часов, выход 2‑ацетоксиметил–3,4–диметил–5–карбоэтоксипиррола (44) составил 82%. Синтез 1,14-дикарбоэтокси-2,3,12,13-тетраметил трипирана (45) проводили конденсацией в метаноле 1 эквивалента пиррола и 2 эквивалентов 2‑ацетоксиметил–3,4–диметил–5–карбоэтоксипиррола (44) в присутствии толуолсульфокислоты при нагревании до 600 в течение 7 часов, выход 1,14-дикарбоэтокси-2,3,12,13-тетраметил трипирана (45) составил 51%. Все синтезированные продукты были охарактеризованы спектральными методами и были определены их физико-химические константы.
