Скорость образования, расходования компонента и скорость реакции
Для любой элементарной реакции
а1А1 + а2А2 + а3А3 → Продукты
уравнение скорости реакции (закон действующих масс) будет иметь вид:
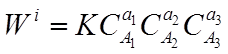
Показатели степени а1 а2 аз - называют порядками реакции по веществам А1 А2, А3.
Сумма 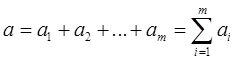 (9)
(9)
- называется общим или суммарным порядком реакции.
Следовательно, порядок реакции равен сумме показателей степеней в уравнении зависимости скорости реакции от концентрации исходных веществ.
Для элементарной реакции он равен сумме (положительных значений) стехиометрических коэффициентов исходных веществ в уравнении реакции (или стадии реакции).
Порядок элементарных реакций не бывает больше трех. Связано это с тем, что порядок реакции отражает в какой-то мере количество частиц участвующих в элементарном акте реакции. Вероятность одновременной встречи четырех частиц практически равна нулю. Поэтому
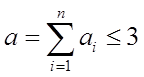
Зависимость скорости реакции от концентрации реагирующих веществ называется кинетическим уравнением. Для элементарных реакций может быть только шесть типов кинетических уравнений в соответствии с числом видов химических уравнений.
Для сложных химических реакций, состоящих из нескольких элементарных стадий, может быть степенная зависимость скорости реакции от концентрации с показателями степени отличными от стехиометрических:
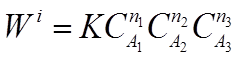
где п1 п2 п3 - порядки реакции по веществам А1 А2 А3. Общий порядок реакции равен:
п= п1+ п2+ п3 .
При этом значения п1 п2 п3 могу быть не равны стехиометрическим коэффициентам, иметь дробные величины и больше трех.
1.3 Молекулярность и порядок реакции
При изучении реакций выделяют молекулярность и порядок реакции.
Молекулярность реакции - это число молекул исходных веществ, принимающих участие в одном (единичном) химическом превращении. При этом число молекул образующихся продуктов не имеет значения.
В соответствии с приведенным определением различают реакции:
1) мономолекулярные, в которых только один вид молекул участвует в превращении, причем стехиометрический коэффициент в уравнении равен единице, например,
запись А → С означает, что молекула вещества А превращается в молекулу вещества С;
2) бимолекулярные, в которых участвуют два различных вида молекул или две молекулы одного вида (стехиометрический коэффициент во втором случае равен двум), например, А + В→С или 2А → С;
3) тримолекулярные, в которых участвуют три молекулы одного или разного видов, например,
А + В + D → С или
2 А + В → С, или 3А→С.
Реакции более высокой молекулярности маловероятны. Связано это с причиной, о которой говорилось ранее.
Выше было сказано, что порядок химической реакции выражается
суммой:
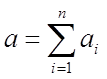
где аi - показатели степени концентрации исходных веществ в уравнении действующих масс.
Они приравнивались стехиометрическим коэффициентам компонентов химической реакции. Исходя из этого можно сделать заключение, что молекулярность и порядок реакции это одинаковые величины. Однако, это не всегда так. Порядок реакции или равен молекулярности или, в большинстве случаев, меньше её. Расхождение между порядком реакции и её молеклярностью может быть вызвано разными причинами.
1. Молекулярность реакции величина теоретическая, а порядок реакции - экспериментальная. Между теоретическими и экспериментальными величинами почти всегда есть различия.
2. Если, например, в реакции
bB + dD = P,
скорость которой W = КСBbCD d
один из компонентов, например, компонент B, находится в избытке, то в ходе данной реакции его концентрация будет изменяться незначительно и в уравнении скорости реакции можно принять СB = const. Но в таком случае скорость реакции практически зависит от концентрации только компонента D, то есть W = К1CD d тогда порядок реакции равен d, а молекулярность реакции (b + d).
3. Если данная реакция является гетерогенной, то в зависимости от условий протекания порядок такой реакции может быть различным.
4. Порядок каталитической реакции также может отличаться от молекулярности, причина - сложный механизм таких реакций.
5. Для сложной реакции, протекающей в несколько стадий, порядок реакции и её молекулярность не совпадают. В данном случае порядок реакции определяет какая-либо промежуточная (лимитирующая) стадия. Как правило порядок этой стадии отличается от молекулярности сложной реакции.
1.4 Кинетические уравнения химических реакций в закрытых системах
Кинетические уравнения представляют зависимость концентрации веществ, участвующих в реакции от времени:
Сi=f(τ).
Получим уравнения для зависимости концентрации исходных веществ от времени для элементарных формально простых реакций первого, второго и третьего порядков. Реакции гомогенные, односторонние (необратимые), протекают в закрытых системах при Т = const и V= const.
1.4.1 Односторонние реакции 1— порядка
Это реакции вида:
А → Продукты.
Выражение для скорости реакции имеет вид:
W = K1C. (10)
Она связана со скоростью расходования исходного вещества А соотношением:
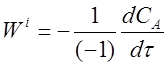
где (- 1) - стехиометрический коэффициент исходного вещества А. Подставляя это выражение в уравнение (10) и опуская для простоты индекс А, получим:
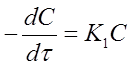 (11)
(11)
Из этого равенства нужно найти в явном виде зависимость концентрации вещества А от времени.
Разделим переменные в уравнении (11):
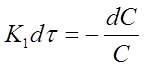
Проинтегрируем полученное уравнение при изменении времени в пределах от 0 до τ и концентрации от 0 до С
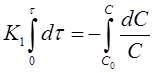
и получим
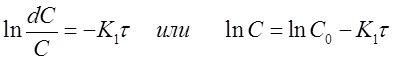 (12)
(12)
Полученная формула позволяет вычислить концентрацию исходного вещества A в любой момент времени протекания реакции при известной концентрации С0 и константе скорости К1, если провести её потенцирование:
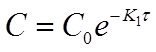
где С0 - начальная концентрация исходного вещества А в момент времени τ=0;
С - концентрация этого вещества к моменту времени г,
К1 - константа скорости реакции 1ого порядка. Она имеет размерность - 1/время (с, мин, ч). Индекс 1 означает порядок реакции.
Из уравнения (12) можно получить выражение для вычисления константы скорости реакции 1го порядка:
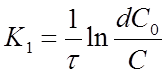 , 1/время.
, 1/время.
Уравнение (12) можно представить несколько в ином виде. Обозначим х - уменьшение концентрации исходного вещества к моменту времени τ, тогда
