Современное содержание термина активация
Для описания природы связи в комплексах в настоящее время используют три теории:
1) метод валентных связей (МВС);
2) теория кристаллического поля (ТКП);
3) метод молекулярных орбиталей (ММО).
Ни одна из этих теорий не является всеобъемлющей, поэтому возможно использование той, которая наилучшим образом описывает строение того или иного комплексного соединения.
Номенклатура комплексов
1. Порядок перечисления ионов:
В русскоязычной литературе сначала называют анион, а затем – катион; в англоязычной литературе – наоборот:
K2[PtCl6] – гексахлороплатинат (IV) калия (potassium hexachloroplatinate).
Неионные (молекулярные) соединения называют одним словом:
[Co(NH3)3(NO2)3] – тринитротриамминкобальт(III).
2. Названия лигандов
Нейтральные лиганды называют так же, как и соответствующую молекулу; к лигандам-анионам добавляют на конце суффикс –о-.
Имеется два исключения из этого правила – вода и аммиак:
H2O –акво,
NH3 –аммин (следует указать, что это название пишется с двумя «м»; другие амины пишутся с одним «м»).
3. Порядок перечисления лигандов в комплексе.
Лиганды в комплексе называют в следующем порядке:
1) отрицательные, 2) нейтральные, 3) положительные, не разделяя их дефисами. Внутри каждой из этих категорий лиганды перечисляются в порядке увеличения их сложности:
[Pt(NH3)4(NO2)Cl]SO2 – сульфат хлоронитротетраамминплатины (IV).
2) Числовые приставки
Приставки ди-, три-, тетра- и так далее применяют перед названием простых лигандов: бромо, нитро, оксалато. Приставки бис-, трис-, тетракис- и так далее применяют перд сложными наименованиями лигандов:
[Co(en)2Cl2]2SO4 – сульфат дихлоро-бис-(этилендиамин)кобальта(III), где en = H2NCH2CH2NH2- этилендиамин.
3) Окончания названий.
Названия анионных комплексов оканчиваются на «ат». В катионных или нейтральных комплексах металл называют без какого-либо специфического окончания:
Ca2[Fe(CN)6] – гексацианоферрат((II) кальция,
[Fe(H2O)6]SO4 – сульфат гексааквожелеза(II)
[Ni(DMG)2] – бис-(диметилглиоксимато)никель(II), где
DMG = CH3(HO-N=)C-C(=N-OH)CH3 – диметилглиоксимат-ион.
4) Место присоединения лиганда.
Если необходимо указать место присоединения лиганда, после названия группы курсивом ставят обозначение присоединяемого элемента, которое отделяют дефисом:
(NH4)3[Cr(NCS)6] – гексатиоцианато-N-хромат(III) аммония,
(NH4)2[Pt(SCN)6] – гексатиоцианато-S-платинат(IV)/
Для тиоциана- и нитрат-ионов используют также следующие названия:
-SCN- - тиоцианато, -NO2- - нитро,
-NCS- - изотиоцианато, -ONO- - нитрито.
Классификация комплексов
Возможны различные виды классификации комплексных соединений.
1. Комплексы могут быть моноядерными и полиядерными.
В первом случае в координационную сферу всходит один металл-комплексообразователь, во втором – несколько металлов.
Примеры: K2[PtCl6], [Co(NH3)3(NO2)3] , K3[Co(NO2)6] – моноядерные комплексы;
Pt4(OCOCH3)8 – тетраядерный (полиядерный) комплекс.
2. Комплексы могут быть нейтральными, анионными или катионными.
Примеры: K2[PtCl6] –анионный комплекс,
[Co(NH3)3(NO2)3] – нейтральный комплекс
[Co(NH3)6]Cl2.- катионный комплекс.
3. Комплексы можно классифицировать по координационному числу КЧ (т.е. количеству координированных лигандов). КЧ бывают равными 1,2,3,4,5,6,7,8 и9.
Для моноядерных соединений наиболее часто встречаются КЧ 4 и 6.
4. Комплексы можно классифицировать по координационному полиэдру.
Координационный полиэдр – это геометрическая фигура, которая образуется после соединения прямыми линиями всех лигандов (их первых атомов). В центре такой фигуры располагается ион металла. Для моноядерных соединений характерны полиэдры в виде плоского квадрата, тетраэдра и октаэдра.
Примеры:
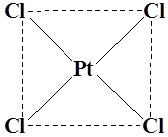
K2[PtCl4] (плоский квадрат)
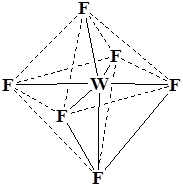
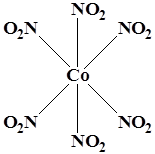
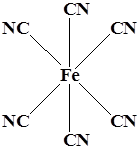
WF6 K3[Co(NO2)6] K3[Fe(CN)6]
Октаэдр
3. Комплексы можно классифицировать, исходя из химической природы лигандов.
.
Координационная емкость лигандов (или дентатность) – это число координационных мест, которое занимает у центрального атома данный лиганд.
Примеры: монодентатные лиганды – аммиак, галогены, халькогены, и т.д.
Полидентатные лиганды – с.22 и далее
Бидентатные: карбонат, оксалат, этилендиамин
Тридентатные: диэтилентриамин
Тетрадентатные: этилендиаминтетрауксусная кислота .
Полидентатные лиганды, содержащие электронодонорные функциональные группы различного типа –кислотные и основные – называют комплексонами.
Пример: соль Цейзе – атомы этилена расположены на одинаковом расстоянии от атома платины и координационную емкость этилена можно было бы считать равной 2. Однако координационная емкость лиганда определяется числом монодентатных лигандов, которые могут заместить данный лиганд или которые замещаются данным лигандом. Поэтому для этилена КЕ = 1.
Классификация комплексов по химической специфике лигандов
1. Атомы элементов в качестве лигандов (H, O, N, C, S, Se, F, Cl и др.). Некоторые из них – координируются в виде одно- или двухзарядных анионов, другие не существуют в индивидуальном состоянии в мягких условиях (N, O, S).
ПРИМЕРЫ КОМПЛЕКСОВ
А) гидридные комплексы (например, гидриды рения). В комплексе рения [ReH9]2- шесть атомов водорода находятся в вершинах тригональной призмы, а три атома водорода образуют правильный треугольник, лежащий на одинаковых расстояниях от обоих оснований призмы. Металл-комплексообразователь находится в центре этого треугольника.
б) галогенидные комплексы:
Например, соединение K2PdCl4 является анионным комплексом и содержит тетрахлоропалладат-анион (PdCl4)2- (см. рис. выше).
В) Халькогенидные комплексы, т.е. содержащие серу, селен, теллур, связанные с центральным атомом. Примеры:

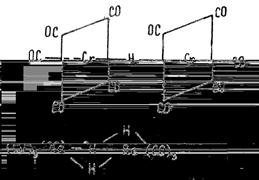
Как правило, комплексы содержат лиганды разного типа или лиганды, состоящие из разных атомов. Например, карбонилгидридные комплексы содержат одновременно и карбонильные (СО), и гидридные (Н-) лиганды, как это видно на примере карбонилгидридов хрома [(CO)5Cr]2(μ-H) или рения (CO)3Re(μ-H)3Re(CO)3.
: 
В связи с вышесказанным такая классификация употребима главным образом для галогенидных или халькогенидных комплексов.
2. В качестве лигандов часто выступают отрицательно заряженные группы атомов – анионные лиганды –
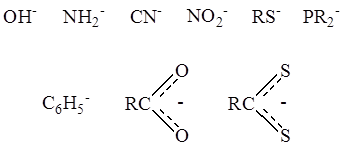
Примером может служить кластерный комплекс платины состава Pt4(OCOCH3)8 :