Теория Бутлерова
которые существенно отличаются по свойствам.
5. Изомерия, характерная для органических соединений, в молекулах которых имеется бензольное кольцо.
Этот вид изомерии возможен при наличии двух заместителей в бензольном кольце. В зависимости от расположения заместителей в бензольном кольце различают орто-, мета- и пара-изомерию. Так, например, если в бензольном кольце имеется два заместителя — радикал метил и гидроксильная группа, то такое вещество называется крезолом. И в зависимости от расположения этих групп в бензольном кольце существует три различных вещества:
|
C-CH3 HC C-OH HC CH CH |
C-CH3 HC CH HC C-OH CH |
C-CH3 HC CH HC CH C-OH |
| о-крезол | м-крезол | n-крезол |
Следует учесть, что многие соединения, имеющие одну и ту же молекулярную формулу, могут отличаться между собой различными видами изомерии, например:
|
CH3 O |
O |
|
| // |
// |
|
CH3 – C – C |
NH2 – CH2 – CН – C |
|
| \ |
| \ |
|
NH2 OH |
CH3 OH |
| 2-амино-2метилпропановая кислота | 3-амино-2-метилпропановая кислота |
| CH3 – CH2 – CH – CООН |
|
| |
|
NH2 |
| 2-аминобутановая кислота |
Эти изомерные вещества отличаются одновременно изометрией углеродной цепи и изометрией положения функциональной группы – NH2.
III. Например, из молекулы этанола натрий вытесняет только один атом водорода. Следовательно, этот атом водорода более подвижен.
Отсюда можно вывести структурную формулу этанола:
H H
| |
H – C – C – H
| |
H H
Наоборот, зная структурную формулу этанола, можно предвидеть, что натрий будет вытеснять только один атом водорода, который связан с атомом кислорода.
Изучая свойства глюкозы, мы убедились, что в ее молекуле пять групп – он и одна альдегидная группа. Наоборот, зная структурную формулу глюкозы, можно предвидеть, что глюкоза будет проявлять свойства альдегидов и спиртов.
IV. Химические свойства фенола обусловлены наличием в его молекуле гидроксильной группы и бензального ядра, которые взаимно влияют друг на друга. Наличие гидроксильной группы предопределяет сходство фенола со спиртами:
1. Сходство, сходное со свойствами спиртов:
2C6H5OH + 2 Na → 2C6H5ONa + H2 ↑
2. Свойство, отличающееся от свойств спиртов:
C6H5OH + NaOH → C6H5ONa + H2O
3.
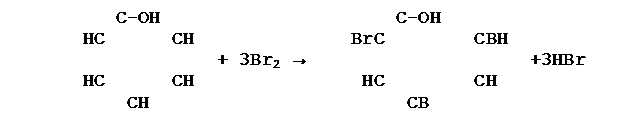 |
4. Реакция нитрования
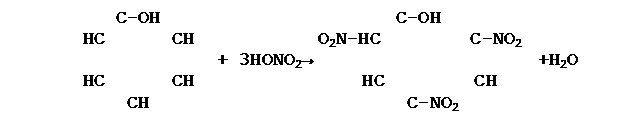 |
Влияние бензольного ядра на гидроксильную группу обуславливает большую подвижность ее водородного атома. Поэтому фенол, в отличие от спиртов, реагирует со щелочами, т.е. обладает свойствами слабых кислот. Его иногда называют карболовой кислотой. Это объясняется тем, что бензольное ядро оттягивает к себе электроны кислородного атома гидроксильной группы. Чтобы компенсировать это, атом кислорода сильнее притягивает к себе электронную плотность от атома водорода. Вследствие этого кавалентная связь между атомами кислорода и водорода становится более полярной, а атом водорода – более подвижным. Гидроксильная группа в свою очередь придает атомам водорода большую подвижность в положении 2, 4, 6. Это один из многих примеров, подтверждающих тезис теории А.М. Бутлерова о взаимном влиянии атомов в молекулах.
Химические свойства анилина обусловлены наличием в его молекуле аминогруппы - NH2 и бензольного ядра. Анилин более слабое основание. Чтобы ответить на этот вопрос, нужно вспомнить о взаимном влиянии атомов и атомных групп в молекулах. Как и в молекулах фенола (об этом говорилось раньше) бензольное ядро несколько оттягивает свободную электронную пару от атома азота аминогруппы. Вследствие этого электронная плотность на атоме азота в молекуле анилина уменьшается и он слабее притягивает к себе протоны, т.е. основные свойства анилина ослабляются. Важнейшие свойства анилина:
1. Реагирует с кислотами с образованием солей:
C6H5 – NH2 + HCl → C6H5 NH3 Cl
2. Образовавшиеся соли реагируют со щелочами и снова выделяются анилин:
C6H5 – NH3 Cl+ NaOH → C6H5 NH2 + Na Cl + H2O
3. Энергично участвует в реакциях замещения, например реагирует с бромной водой с образованием 2, 4, 6 – триброманилина:
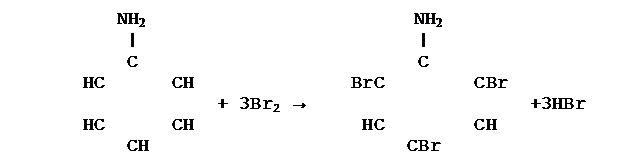 |
Взаимное влияние атомов в молекулах галогенопроизводных углеводород.
Самое характерное химическое свойство предельных углеводородов – реакции замещения. Примером такой реакции является взаимодействие предельных углеводородов с галогенами. Аналогично с галогенами реагируют и другие предельные углеводороды:
CH3-CH3+Cl2 → CH3-CH2-Cl+HCl
Галогенопроизводные углеводороды обладают некоторыми особенностями. Согласно теории А.М. Бутлерова, это объясняется взаимным влиянием атомов и атомных групп в химических соединениях. С точки зрения современных представлений об электронных облаках и их взаимном перекрывании, с учетом электроотрицательности химических элементов взаимное влияние атомов и атомных групп, например в метилхиориде, объясняется так. У атомов хлора электроотрицательность больше, чем у атомов углерода. Поэтому электронная плотность связи смещена от атома углерода в сторону атома хлора. Вследствие этого атом хлора приобретает частичный отрицательный заряд, а атом углерода – частичный положительный заряд. Приобретаемые частичные заряды обозначаются δ+ и δ- :
