Теория химико-технологических процессов органического синтеза
Термодинамические свойства формальдегида рассчитываем методом Бенсона. Полученные результаты представлены в таблице.
|
|
|
| |
|
298 |
35,44 |
-108790,00 |
224,56 |
|
400 |
39,25 |
-110505,00 |
235,55 |
|
500 |
43,76 |
-112133,68 |
244,81 |
|
600 |
48, 20 |
-113618,38 |
253, 20 |
|
800 |
55,94 |
-116063,03 |
268,18 |
|
1000 |
61,97 |
-117821,73 |
281,33 |
По полученным данным рассчитываем термодинамические характеристики процесса:
![]()
![]()
Рассчитаем константу равновесия реакции ![]() при стандартном давлении для диапазона температур:
при стандартном давлении для диапазона температур:
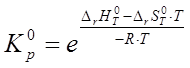 .
.
Результаты расчетов сводим в таблицу:
|
|
| |
|
298 |
158574,80 |
388,41 |
|
400 |
166620,46 |
391,47 |
|
500 |
173295,78 |
390,45 |
|
600 |
179325,50 |
387,84 |
|
800 |
190676,71 |
381,98 |
|
1000 |
201989,69 |
376,59 |
Т. о., можно сделать вывод, что реакция эндотермическая, т.е. при увеличении температуры увеличивается скорость прямой реакции. По уравнению реакции можно сделать вывод, что при увеличении давления реакция разложения диоксана замедлится, т.е. увеличение давления в реакторе нежелательно.
Рассчитаем константу равновесия для различных температур
Кр = exp(-∆G/R*T), где ∆G = ∆Gвода + ∆Gформальд + ∆Gизопрен - ∆Gдмд
|
Т |
∆G |
Кр |
|
298 |
31860,41 |
2,60122E-06 |
|
400 |
-15415,4 |
103,0660931 |
|
500 |
-44317,5 |
42656,70466 |
|
600 |
-100209 |
530048492,7 |
|
800 |
-192507 |
3,71431E+12 |
|
1000 |
-283127 |
6,15968E+14 |
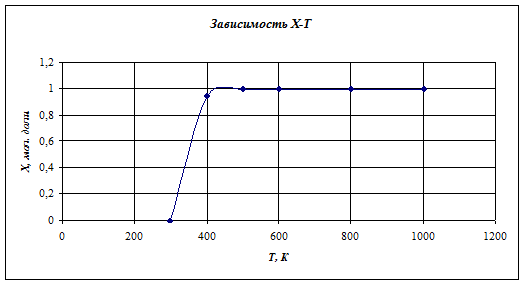
Определим степень конверсии при различных температурах
Х = (-Кр*n + Kp^2*n^2+4*(Kp+Pобщ) *(n+1) *Kp) /(2*Kp+Pобщ)
где n – кол-во молей инертного разбавителя
Pобщ – общее давление
|
T |
X |
|
298 |
0,00032045 |
|
400 |
0,945420958 |
|
500 |
0,999999972 |
|
600 |
1 |
|
800 |
1 |
|
1000 |
1 |
Рассчитаем конверсию при 400 0С и различном давлении.
|
P, кПа |
Х |
|
101,325 |
0,945420958 |
|
202,65 |
0,87085756 |
|
303,975 |
0,80605074 |
|
405,3 |
0,752055369 |
|
506,625 |
0,706888107 |
|
607,95 |
0,668627628 |
|
709,275 |
0,635780158 |
|
810,6 |
0,607228688 |
|
911,925 |
0,582137699 |
|
1013,25 |
0,559874927 |
