Теория химико-технологических процессов органического синтеза
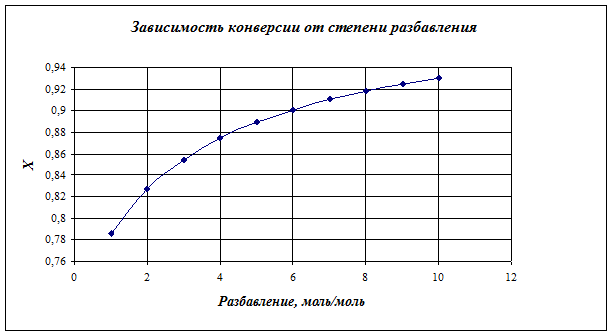
Рассчитаем конверсию при различном разбавлении
|
n Н2О |
Х |
|
1 |
0,78575 |
|
2 |
0,827174 |
|
3 |
0,854574 |
|
4 |
0,874226 |
|
5 |
0,889079 |
|
6 |
0,90073 |
|
7 |
0,91013 |
|
8 |
0,91788 |
|
9 |
0,924386 |
|
10 |
0,929927 |
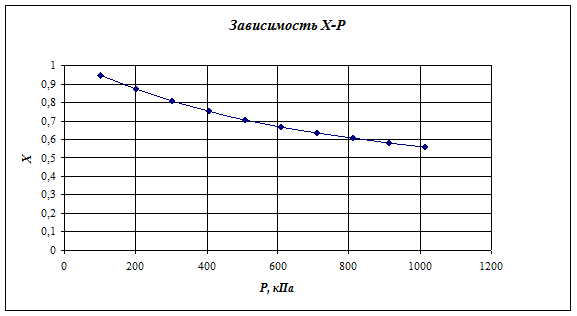
Наиболее подходящие условия для проведения процесса: 400 0С при дальнейшем повышении температуры увеличивается выход изобутилена и возрастает опасность полимеризации изопрена. Давление атмосферное. Для компенсации эндотермичности реакции разбавляют диоксан перегретым водяным паром 1: 2, который служит аккумулятором тепла и способствует повышению селективности процесса. Так как реакция разложения ДМД до изопрена идет через стадию дегидрирования, то сильное разбавление отрицательно скажется на выходе изопрена.
Адиабатический перепад температур.
Предположим, что масса пропускаемого 4,4-диметилдиоксана 1,3 равна 1000 кг, тогда количество молей 4,4-диметилдиоксана-1,3, подаваемого в реактор за час:
νн-бутан = ![]()
Где m – подаваемая масса н-бутана, кг/час; M – молярная масса н-бутана, кг/кмоль
νн-бутан= ![]() =8,62 (кмоль/час)
=8,62 (кмоль/час)
На 1 моль н-бутана подается 2 моля водяного пара.
В программе Microsoft Excel построим графики зависимости теплоемкости от температуры для 4,4-диметилдиоксана-1,3, изопрена, формальдегида и воды. А также для каждого из графиков определим линию тренда по полиномиальной зависимости третьего порядка:
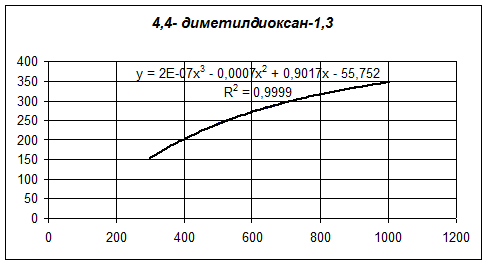
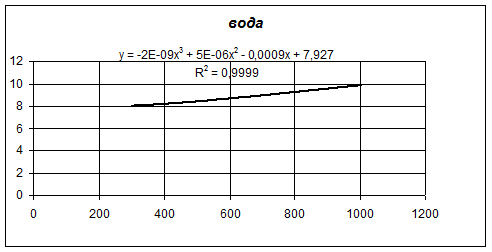
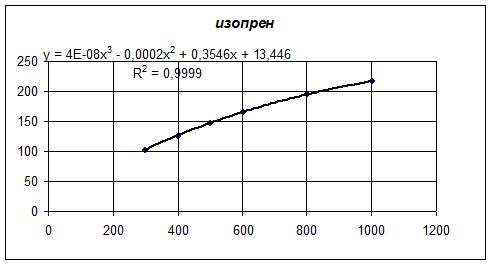
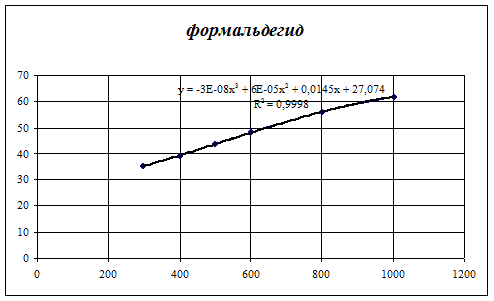
Количество тепла, входящее в предконтактную зону реактора, складывается из тепла, вносимого с 4,4-диметилдиоксана 1,3 и водяным паром.
Qвх = ν![]() ν
ν![]() =
=
=![]() = 1148557,672 (кДж/час)
= 1148557,672 (кДж/час)
Необходимо найти температуру выходящей смеси из предконтактной зоны, для этого нужно знать температуру входящей смеси. После смешения 4,4-диметилдиоксана-1,3 и водяного пара их температура будет равна Tвх. Таким образом Qвх равно:
Qвх = ![]()
Используя функцию "подбор параметра" в программе Microsoft Excel находим:
Tвх. = 4490
Энтальпия реакции из следствия закона Гесса равна:
![]() =
= ![]() -
- ![]() =
= ![]() +
+![]() -
- ![]()
![]() = 301,72(кДж/моль)
= 301,72(кДж/моль)
Реакция эндотермическая.
Найдем теплоту реакции. Qреакции = GДМД ![]()
Qреакции = - ![]() = - 260106, 9 (Дж/час)
= - 260106, 9 (Дж/час)
Количество тепла, выходящее со смесью из предконтактной зоны, равно:
Qвых = Qвх + Qреакции – Qпот
Qпот = 0,03* Qвх = 0,03* 1148557,67 = 34456,73 (Дж/час), так как при протекании процесса происходит потеря тепла в окружающую среду в размере 3% от приходящего тепла в реактор.
Qвых = 1148557,672 - 260106,9 - 34456,73 = 853994,05 (Дж/час)
Также количество тепла, выходящее со смесью, можно рассчитать через Tвых, ср.
Qвых = ![]()
![]()
При К = 1 с помощью функции "подбор параметра" находим Tвых, ср = 414 0С.
Кинетический анализ
Механизм реакции на настоящий момент мало изучен. Можно предположить, что реакция протекает по следующей схеме:
· Сначала протекает каталитический гидролиз с отщеплением формальдегида:
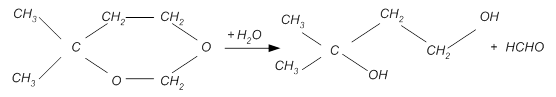
Предположительно, данная стадия является лимитирующей. При этом используются различные гетерогенные катализаторы кислотного типа (фосфорная кислота на носителях, фосфаты, силикагель и др.), причем реакцию осуществляют в газовой фазе при 250-4000С.
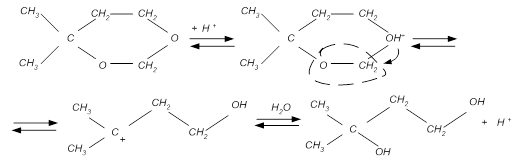
· Практически сразу происходит дегидратация полученного переходного соединения:
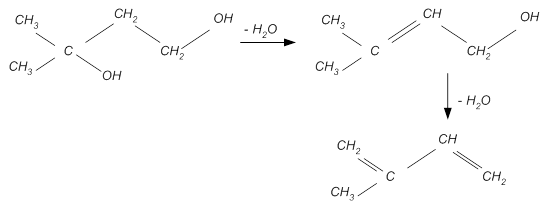
При этом протекают побочные реакции разложения диоксана:
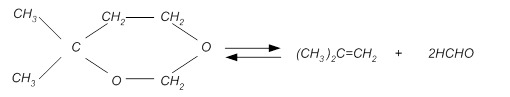
В связи с отсутствием экспериментальных кинетических данных по отношению к реакциям данного типа представляется затруднительным создание точной кинетической модели.
Выводы
На основании результатов анализа принимаются следующие технологические решения:
· Пары диоксана разбавляются перегретым водяным паром при поступлении в адиабатический реактор;
· Реакционная смесь конденсируется в холодильнике и разделяется в сепараторе на водный и органический слои;
· Органический слой, содержащий изопрен подают последовательно в две ректификационные колонны. В первой отгоняется образовавшийся при разложении диоксана изобутилен, поступающий на первую стадию синтеза, во второй колонне изопрен отделяется от более высококипящего остатка (диоксан и побочные продукты);
