Термодинамическая оптимизация процессов разделения
![]()
Здесь: ![]() - удельная энтальпия j-того материального потока,
- удельная энтальпия j-того материального потока, ![]() - поток энергии, приносимый вместе с молем вещества, поступающего диффузно.
- поток энергии, приносимый вместе с молем вещества, поступающего диффузно.
Энтропийный баланс.
Изменение энтропии системы S происходит вследствие притока энтропии вместе с веществами, поступающими конвективно и диффузионно, притока и отвода тепла и производства энтропии ![]() вследствие неравновесности процессов, происходящих внутри самой системы:
вследствие неравновесности процессов, происходящих внутри самой системы:
![]() ,
,
где ![]() - изменение энтропии под влиянием j-того потока тепла с температурой
- изменение энтропии под влиянием j-того потока тепла с температурой ![]() .
.
Производство энтропии (диссипация энергии) заведомо неотрицательно. Отметим, что если рассматривается стационарный режим процесса, когда ![]() , то эти уравнения из дифференциальных превращаются в алгебраические.
, то эти уравнения из дифференциальных превращаются в алгебраические.
При рассмотрении циклического процесса балансы можно записать не для каждого момента времени, а за цикл работы установки. Так как в начале и конце цикла состояние системы одинаково, то общее изменение энергии, количества вещества и энтропии за цикл равно нулю. Балансы в этом случае также сводятся к системе соотношений, связывающих средние за цикл значения слагаемых, стоящих в правых частях уравнений.
Для закрытых систем, состоящих из нескольких равновесных подсистем, термодинамические балансы имеют форму
![]() ;
; ![]() ;
; ![]()
где i - номер подсистемы, а индекс «0» относится к системе в целом. В свою очередь ![]() ,
, ![]() ,
, ![]() определяются соотношениями термодинамических балансов.
определяются соотношениями термодинамических балансов.
Производство энтропии в различных типовых процессах
Поскольку в балансовые уравнения входит производство энтропии, то, исходя из них, можно получить выражения, позволяющие рассчитать производство энтропии. Рассмотрим несколько конкретных примеров выражений для производства энтропии в стационарном режиме.
Статический режим обмена между двумя термодинамическими подсистемами возможен, если в процессе обмена интенсивные переменные подсистем неизменны.
Подсистемы, интенсивные переменные которых не изменяются при обмене веществом и энергией, называются термодинамическими резервуарами (источниками бесконечной ёмкости). Каждая из подсистем является равновесной. Именно такие системы будут рассмотрены ниже. Везде предполагается, что смеси веществ представляют собой идеальные растворы. Давление (если специально не оговорено иное) в ходе взаимодействия не изменяется и во всех взаимодействующих подсистемах одинаково.
Теплообмен.
Пусть происходит обмен теплом между двумя резервуарами с температурами ![]() и
и ![]() (рис. 2).
(рис. 2).
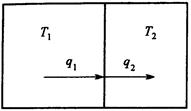
Рис.2. Схема потоков в процессе теплообмена
Энергетический и энтропийный балансы в этом случае имеют вид:
![]() ,
, ![]() .
.
Отсюда получим выражение для производства энтропии:
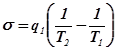
Изотермический массообмен
Пусть два резервуара обмениваются потоками вещества, состоящего из нескольких компонентов. Векторы химических потенциалов в подсистемах равны ![]() и
и ![]() (рис.3).
(рис.3).
Рис.3. Схема потоков в процессе изотермического массобмена
![]()
Неизотермический массообмен
Подсистемы обмениваются компонентами, причём температуры подсистем различаются (рис.4).
Рис.4. Схема потоков в процессе неизотермического массобмена
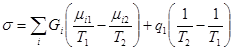 ,
,
где ![]() - приток энергии с потоком подводимого вещества.
- приток энергии с потоком подводимого вещества.
Изотермический химический процесс
Пусть в открытой подсистеме при постоянной температуре происходит несколько химических реакций вида
![]() ,
,
со скоростями ![]() . Для поддержания стационарного режима исходные вещества подаются в подсистему, а получаемые отводятся в требуемых количествах равновесно, т.е. при тех же значениях химических потенциалов (рис.5).
. Для поддержания стационарного режима исходные вещества подаются в подсистему, а получаемые отводятся в требуемых количествах равновесно, т.е. при тех же значениях химических потенциалов (рис.5).
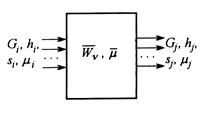
Рис.5. Схема потоков в системе с химическими превращениями
![]() ,
,
где ![]() - химическое сродство n-той химической реакции.
- химическое сродство n-той химической реакции.
Тепломассообмен с химическими превращениями
Пусть к подсистеме подводятся тепло от источника с температурой ![]() и исходные вещества при температуре
и исходные вещества при температуре ![]() , а отводятся продукты реакции при температуре подсистемы
, а отводятся продукты реакции при температуре подсистемы ![]() (рис.6).
(рис.6).
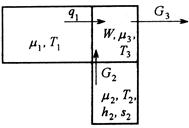
Рис.6. Схема потоков в процессе тепломассообмена с химическими превращениями
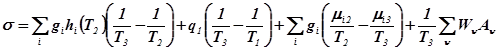
Необходимо определить условия организации процесса на каждой из его стадий, когда при заданной интенсивности процесса минимизируется количество производимой энтропии, нахождение минимально возможных значений производства энтропии и соответствующих им функций изменения параметров процесса (концентраций, температур, давлений).
Поскольку производство энтропии обладает свойством аддитивности, то для процесса, идущего в несколько стадий, общее производство энтропии равно сумме производства энтропии на каждой из стадий. Для каждой стадии находят минимальное производство энтропии при тех или иных условиях, внешних для данной стадии. Суммируя найденные значения и оптимальным образом подбирая условия на границах стадий, получим минимально-возможное количество произведённой энтропии ![]() во всём процессе в целом.
во всём процессе в целом.
