Учёт неидеальности растворов в кинетических исследованиях
Для механизма (41)
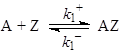
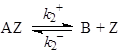 (41)
(41)
величина скорости реакции на центрах одного сорта
![]() (42)
(42)
Запишем для kj выражения ![]()
![]()
![]() ,
, ![]() и
и ![]() где
где ![]() . После интегрирования получим уравнение
. После интегрирования получим уравнение
![]() (43)
(43)
которое, как легко видеть, сильно отличается от уравнения (42)
В качестве примера кинетики промышленного процесса на неоднородной поверхности приведем знаменитое уравнение синтеза аммиака (М. И. Темкин) на железном катализаторе, которое описывает процесс синтеза NH3 в очень широком интервале давлений (1 – 70 атм.).
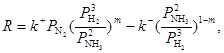 (44)
(44)
где m = 0,5 для железного катализатора, k+/k– = K – константа равновесия итогового уравнения.
При выводе уравнения принимаем, что поверхность катализатора неоднородна в отношении адсорбции N2 (логарифмическая изотерма), и что диссоциация N2 до атомарного состояния является лимитирующей стадией процесса
Z+N2![]() ZN2
ZN2
ZN2+Z![]() 2ZN
2ZN
2ZN+H2![]() 2ZNH
2ZNH
ZNH+H2![]() Z+NH3,
Z+NH3,
протекающего по итоговому уравнению:
N2+3H2![]() 2NH3
2NH3
Статистическое планирование кинетического эксперимента
При планировании кинетического эксперимента важно выбрать статистически обоснованную область изменения параметров , чтобы охватить все возможные сочетания концентраций реагентов и найти такие области концентраций, для которых поведение кинетических уравнений различалось бы наиболее заметно. Например очевидно, что уравнения (45) и (46)
![]() (45)
(45)
![]() (46)
(46)
будут различными только при больших концентрациях СА
Параболический характер зависимости R от CA в уравнение (47), напротив будет заметен в области малых концентраций СА
![]() (47)
(47)
В настоящее время разработан математический аппарат для планирования кинетических экспериментов.
Вопросы для самоконтроля
1) Какие условия должны выполняться при исследовании кинетики гомогенной реакции в системе газ – жидкость в проточном реакторе полного смешения?
2) Перечислить критерии определения внешнекинетического режима проведения гетерогенной каталитической реакции.
3) Перечислить типы идеальных реакторов.
4) Найти уравнение, описывающее зависимость концентрации продукта на выходе из реактора полного смешения от времени контакта для реакции
5) A ® 2B с кинетическим уравнением |RA| = kCA при W = W0.
6) Почему понижение давления переводит процесс в кинетическую область?
7) Что определяет фактор эффективности катализатора?
8) Почему следует поддерживать постоянной ионную силу раствора или ионную среду в кинетических исследованиях?
9) Что произойдет с концентрацией иона H3O+ в воде, если к раствору уксусной кислоты добавить сильный электролит (например, KCl, LiClO4)?
10) Какую поверхность твердого вещества можно считать однородной?
11) В каких условиях образуется идеальный адсорбированный слой?
12) Какая функция распределения активных центров по свободным энергиям (или теплотам) адсорбции соответствует логарифмической изотерме адсорбции?
Литература для углубленного изучения
1. Гаммет Л. Основы физической органической химии, М., Мир, 1972, 534 с.
2. Моисеев И.И. p-Комплексы в жидкофазном окислении олефинов, М., Наука, 1970, 240 с.
3. Киперман С.Л. Основы химической кинетики в гетерогенном катализе, М., Химия, 1979.
4. Розовский А.Я. Гетерогенные химические реакции, М., Наука, 1980, 323 с.
5. Одинцов К.Ю., Брук Л.Г., Темкин О.Н. Статистическая обработка результатов кинетических исследований (методическое пособие), М., МИТХТ, 2000, 50 с.
6. Горский В.Г. Планирование кинетических экспериментов, М., Наука, 1984.
