Фазовые равновесия
Содержание
Введение
2. Правило фаз Гиббса
3. Равновесные состояния при фазовых переходах
3.1 Равновесие газ – жидкий раствор в двухкомпонентных системах
3.1.1 Зависимость растворимости газов в жидкостях от природы газа и растворителя
3.1.2 Зависимость растворимости газов в жидкостях от давления
3.1.3 Зависимость растворимости газов в жидкостях от температуры
3.2 Равновесие жидкость – жидкость в двухкомпонентных системах
3.3 Равновесие пар – жидкий раствор в двухкомпонентных системах
3.3.1 Равновесие пар—жидкий раствор в системах с неограниченной взаимной растворимостью жидкостей
3.3.2 Равновесие пар — жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей
3.3.3 Равновесие пар—жидкий раствор в системах с взаимно нерастворимыми жидкостями
4. Уравнение Клапейрона
5. Уравнение Клаузиуса – Клапейрона
6. Практическая часть
6.1 Вопросы
6.2 Задачи
Заключение
Библиографический список
Введение
Гетерогенная система - система, состоящая из нескольких фаз.
Фазой называется совокупность гомогенных (однородных) частей системы, одинаковых по составу, химическим и физическим свойствам и отграниченных от других частей системы поверхностью. Поверхности раздела фаз образуются некоторым количеством молекул, расположенных на границе области, заполненной данной фазой. Молекулы, образующие поверхностный слой, находятся в особых условиях, вследствие чего поверхностный слой обладает особыми свойствами, не присущими веществу, находящемуся в глубине фазы. Образования, составленные из небольшого числа молекул, не могут быть разделены на поверхностный слой и внутреннюю массу вещества, поэтому к образованиям с очень малым объемом понятие фаза неприменимо. Жидкие и твердые фазы называются конденсированными.
Составляющее вещество системы - это каждое вещество системы, которое может быть выделено из системы и существовать вне ее. Если в системе не протекает химическая реакция, то количество каждого из веществ не зависит от количеств других веществ. Если в системе протекает химическая реакция, то состав фаз равновесной системы можно определить, зная концентрацию только части веществ. Составляющие вещества, концентрации которых определяют состав фаз данной равновесной системы, называют независимыми составляющими веществами или компонентами системы. Свойства системы определяются не только природой компонентов, но и их числом. Число компонентов совпадает с числом составляющих веществ при отсутствии химической реакции или меньше при наличии химической реакции.
|
Система |
Число составляющих веществ |
Число компонентов |
|
Система состоит из H2(г), J2(г), HJ(г); Возможна реакция: H2(г) + J2(г) = 2 HJ(г) Система состоит из СаСО3, СаО,СО2 Возможна реакция: СаСО3(т) = СаО(т) + СО2(г) Система состоит из Н2, Не, Аr; Нет химического взаимодействия |
3 3 3 3 3 3 3 |
2 2 2 2 3 3 3 |
2. Правило фаз Гиббса
В равновесной системе связь между числами фаз, компонентов и термодинамических степеней свободы выражается правилом фаз Гиббса или законом равновесия фаз. Рассмотрим равновесную термодинамическую систему, состоящую из Ф фаз, каждая из которых содержит К компонентов. Примем в качестве параметров, определяющих состояние системы, давление, температуру и концентрации компонентов, выраженные в массовых или молярных долях или процентах. Оценим общее число параметров состояния и число уравнений, связывающих их. Число параметров, одинаковых во всех фазах системы, равно двум (Р и Т). Поскольку концентрации компонентов выражены в массовых или молярных долях или процентах, то для характеристики состава одной фазы достаточно задать (К — 1) концентраций. Концентрация одного из компонентов данной фазы будет определена, если известны концентрации остальных компонентов. Для характеристики состава всех фаз равновесной системы необходимо знать Ф(К — 1) концентраций. Тогда общее число параметров, определяющих состояние равновесной системы, будет равно Ф(К — 1) + 2.
Так как при Р = соnst T=const химические потенциалы компонентов являются функциями их концентраций, например, в идеальном растворе![]() , то число уравнений, связывающих концентрации компонентов равновесной системы, можно определить из равенства химических потенциалов каждого компонента во всех фазах :
, то число уравнений, связывающих концентрации компонентов равновесной системы, можно определить из равенства химических потенциалов каждого компонента во всех фазах :
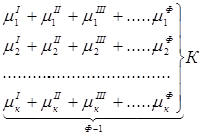 (1)
(1)
Число уравнений, связывающих концентрации одного компонента, равно (Ф — 1), а всех К компонентов — К(Ф — 1). Число независимых параметров состояния системы, т.е. число термодинамических степеней свободы, равно разности между общим числом параметров, определяющих состояние равновесной системы, и числом уравнений, связывающих эти параметры:
С = Ф(К - 1) + 2 - К(Ф - 1),
С=К-Ф + 2. (2)
Уравнение (2) называется правилом фаз Гиббса или законом равновесия фаз: в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только давление и температура. Число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два. Число степеней свободы возрастает с увеличением числа компонентов и уменьшается с увеличением числа фаз. Поскольку число степеней свободы не может быть отрицательным, число фаз в равновесной системе не может превышать К + 2.
Правило фаз было выведено американским физиком Дж. Гиббсом в 1876 г. Учение о фазах в дальнейшем было использовано в работах Я. Вант-Гоффа, Б. Розебома, Н.С. Курнакова и др. и явилось основой изучения равновесий в гетерогенных системах. Если из внешних факторов на систему оказывает влияние только давление (Р=соnst) или температура (T=const), число степеней свободы уменьшается на единицу и уравнение правила фаз (2) принимает вид
СуСЛ = К-Ф+1 (3)
Вариантность системы, рассчитанная по этому уравнению, называется условной (Сусл), а система — условно инвариантной, условно моновариантной и т.д. При постоянстве давления и температуры
Cусл=К-Ф (4)
Если составы двух равновесных фаз, например жидкой и парообразной, одинаковы, то при подсчете числа степеней свободы следует учитывать еще одно уравнение, связывающее концентрации компонентов Х,(ж) = Х,(п). В этом случае вместо уравнения (2) следует пользоваться уравнением
СуСЛ = К-Ф+1 (5)
а вместо уравнения (3) — уравнением
Cусл=К-Ф(6)
Если состояние системы определяется и такими внешними факторами, как электрическое или магнитное поле, поле тяготения и др., то их также следует учитывать при подсчете числа степеней свободы в равновесной системе. В общем случае, когда на систему действуют п различных факторов, то
