Фазовые равновесия
Для изучения равновесия пар – жидкий раствор в системах с ограниченной взаимной растворимостью жидкостей, пользуются диаграммами состояния давление – состав и температура кипения – состав.
3.3.3 Равновесие пар—жидкий раствор в системах с взаимно нерастворимыми жидкостями
Совершенно несмешивающихся жидкостей не существует, так как любые жидкости в какой-то степени растворимы друг в друге. Однако если взаимная растворимость жидкостей ничтожно мала, то эти жидкости можно рассматривать как взаимно нерастворимые. В системах, состоящих из взаимно нерастворимых жидкостей, испарение каждой жидкости происходит независимо от присутствия другой, и давление пара каждого компонента при данной температуре сохраняется постоянным для любых соотношениях жидкостей. Температура кипения смеси из двух взаимно нерастворимых жидкостей ниже температур кипения чистых компонентов, так как общее давление паров (Р) над системой выше давления пара каждого из компонентов в отдельности (![]() и
и ![]() ) и равно
) и равно
![]() .
.
Если паровую фазу рассматривать как смесь идеальных газов, то в соответствии с законом Дальтона состав пара можно определить по уравнению
![]() ;
; ![]()
При заданной температуре пар такого состава изображается фигуративной точкой. Если составы исходной жидкой смеси и пара совпадают, то при изобарном испарении вся жидкость превращается в пар того же состава, а при конденсации такого пара образуются два жидких слоя, суммарный состав которых совпадает с составом исходной смеси. Если составы исходной смеси и пара различны, например жидкая смесь, то при давлении будут испаряться обе жидкости и образуется пар определенного состава. Дальнейшее испарение жидкого компонента приведет к изменению состава пара и к понижению давления над жидкостью. Во всем интервале давлений пар насыщен относительно одного компонента. После исчезновения жидкой фазы пар становится ненасыщенным относительно обоих компонентов и при неизменном составе будет перегреваться. При изотермическом сжатии пара рассмотренные стадии будут происходить в обратной последовательности. Таким образом, испарение и конденсация аналогичных смесей характеризуются наличием некоторого интервала давлений, в котором сосуществуют чистый жидкий компонент и паровая смесь.
4. Уравнение Клапейрона
Термодинамическое обоснование эмпирических соотношений между давлением равновесного пара и температуре было дано Клапейроном в 1834 г. Рассмотрим жидкость, находящуюся в равновесии с ее паром при температуре Т и давлении, равном давлении равновесного пара Р при этой температуре.
Термодинамическим критерием равновесия при постоянных температуре и давлении является равенство изобарных потенциалов для этих двух состояний:
![]() , (16)
, (16)
где «ж» и «пар» — индексы, обозначающие жидкость и пар.
Если температура повысилась до Т+dТ, то для того чтобы обе фазы остались в равновесии, давление должно увеличиться до Р+dР, равного давлению пара при этой более высокой температуре. При бесконечно малом повышении температуры и давления изобарный потенциал для жидкости станет равным G(ж)+dG(ж), а для пара G(пар)+dG(пар). Так как обе фазы находятся в равновесии, то
![]() (17)
(17)
С учетом уравнения (16) условие сохранения равновесия при изменении температуры и давления имеет вид:
![]() (18)
(18)
Так как dG представляет собой полный дифференциал, то уравнение (18) можно написать следующим образом:
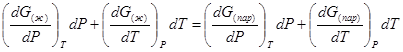 (19)
(19)
На основании уравнений ![]() и
и ![]() уравнение (19) можно переписать в виде
уравнение (19) можно переписать в виде
![]() (20)
(20)
При подстановке получим
![]() (21)
(21)
Так как по уравнению
![]()
![]()
![]() (22)
(22)
где ![]() — изменение энтальпии при испарении жидкости при температуре Т, то уравнение (21) можно написать следующим образом:
— изменение энтальпии при испарении жидкости при температуре Т, то уравнение (21) можно написать следующим образом:
![]() (23)
(23)
Это важное соотношение известно как уравнение Клапейрона. Оно дает зависимость скорости изменения давления равновесного пара с температурой (dР/dТ) от энтальпии испарения ![]() , объема жидкости V (ж) и объема пара V(пар) при температуре Т и давлении, равном давлению насыщенного пара. Вследствие того что вывод уравнения (23) не зависит от каких-либо предположений относительно природы обеих фаз, можно легко вывести такие же уравнения для равновесия между твердым веществом и паром, находящимся в равновесии с ним, а также для равновесия между твердым веществом и жидкостью и между двумя различными кристаллическими формами твердого вещества. Для этих случаев уравнение (23) можно написать так:
, объема жидкости V (ж) и объема пара V(пар) при температуре Т и давлении, равном давлению насыщенного пара. Вследствие того что вывод уравнения (23) не зависит от каких-либо предположений относительно природы обеих фаз, можно легко вывести такие же уравнения для равновесия между твердым веществом и паром, находящимся в равновесии с ним, а также для равновесия между твердым веществом и жидкостью и между двумя различными кристаллическими формами твердого вещества. Для этих случаев уравнение (23) можно написать так:
![]() (24)
(24)
![]()
![]() (25)
(25)
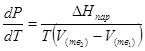 (26)
(26)
где ![]() ,
, ![]() и
и ![]() — энтальпии возгонки, плавления и перехода (между твердым состоянием 1 и 2) соответственно. Теплоты возгонки, плавления и испарения при заданной температуре связаны соотношением
— энтальпии возгонки, плавления и перехода (между твердым состоянием 1 и 2) соответственно. Теплоты возгонки, плавления и испарения при заданной температуре связаны соотношением
![]() (27)
(27)
поскольку количество тепла, необходимое для испарения данного количества твердого вещества, остается постоянным, независимо от того, проводится ли процесс испарения твердого вещества непосредственно или путем первоначального плавления твердого вещества с последующим испарением жидкости. Каждое из этих уравнений можно выразить через мольные величины.
При пользовании уравнениями (23) — (26) необходимо выражать изменение энтальпии процесса в тех же единицах, что и произведение давления на изменение объема. Для этой цели полезно рассчитать множитель для перевода кал в л • атм:
![]()
