Физико-химические методы определения фенола
Фталевый ангидрид Фенолфталеин
При сплавлении фталевого ангидрида с резорцином в присутствии хлорида цинка происходит аналогичная реакция и образуется флуоресцеин:
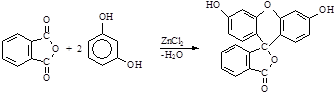
Резорцин Флуоресцеин
3.8 Перегруппировка Кляйзена
Фенолы вступают в реакции алкилирования по Фриделю-Крафтсу. Например, при взаимодействии фенола с аллилбромидом в присутствии хлорида алюминия образуется 2-аллилфенол:
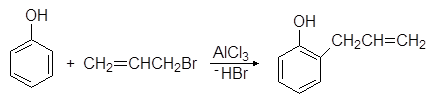
Этот же продукт образуется и при нагревании аллилфенилового эфира в результате внутримолекулярной реакции называемой перегруппировкой Кляйзена:
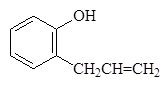 | |||
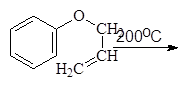 | |||
Аллилфениловый эфир 2-Аллилфенол
Реакция:
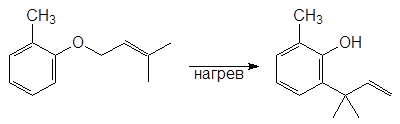
Проходит по следующему механизму:
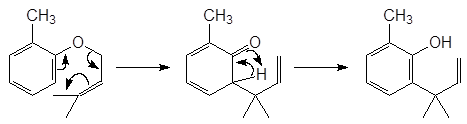
Перегруппировка Кляйзена происходит также и при нагревании аллилвинилового эфира или 3,3 – диметил – 1,5 – гексадиена:
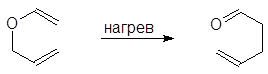
3.9 Поликонденсация
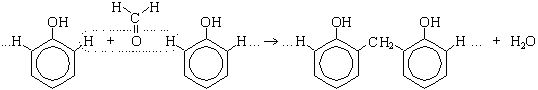
Поликонденсация фенола с формальдегидом (по этой реакции происходит образование фенолформальдегидной смолы:
3.10 Окисление
Фенолы легко окисляются даже под действием кислорода воздуха. Так, при стоянии на воздухе фенол постепенно окрашивается в розовато-красный цвет. При энергичном окислении фенола хромовой смесью основным продуктом окисления является хинон. Двухатомные фенолы окисляются еще легче. При окислении гидрохинона образуется хинон.
3.11 Кислотные свойства
Кислотные свойства фенола проявляются в реакциях со щелочами (сохранилось старинное название «карболовая кислота»):
С6Н5ОН + NaOH <-> C6H5ONa + Н2O
Фенол, однако, является очень слабой кислотой. При пропускании через раствор фенолятов углекислого или сернистого газов выделяется фенол – такая реакция позывает, что фенол – более слабая кислота, чем угольная и сернистая:
C6H5ONa + СO2 + Н2O -> С6Н5ОН + NaHCО3
Кислотные свойства фенолов ослабляются при введении в кольцо заместителей I рода и усиливаются при введении заместителей II рода.
4. Способы получения
Производство фенола в промышленном масштабе осуществляется тремя способами:
– Кумольный метод. Этим способом получают более 95% всего производимиого в мире фенола. В каскаде барботажных колонн кумол подвергают некаталитическому окислению воздухом с образованием гидропероксида кумола (ГПК). Полученный ГПК, при катализе серной кислотой, разлагают с образованием фенола и ацетона. Кроме того, ценным побочным продуктом этого процесса является α-метилстирол.
– Около 3% всего фенола получают окислением толуола, с промежуточным образованием бензойной кислоты.
– Весь остальной фенол выделяют из каменноугольной смолы.
4.1 Окислением кумола
Фенолы выделяют из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения самого фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха с последующим разложением получающейся гидроперекиси, разбавленной H2SO4. Реакция проходит с высоким выходом и привлекательна тем, что позволяет получить сразу два технически ценных продукта – фенол и ацетон. Другой способ–каталитический гидролиз галогензамещенных бензолов.
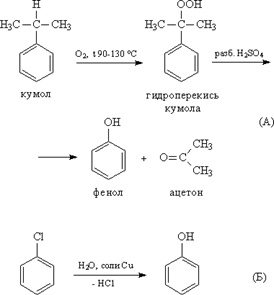
4.2 Получение из галогенбензолов
При нагревании хлорбензола и гидроксида натрия под давлением получают фенолят натрия, при дальнейшей обработке которого кислотой образуется фенол:
С6Н5-CI + 2NaOH -> С6Н5-ONa + NaCl + Н2O
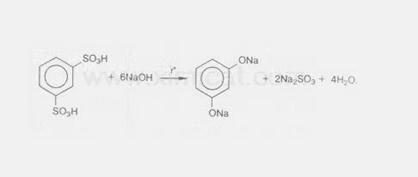
4.3 Получение из ароматических сульфокислот
Реакция проводится при сплавлении сульфокислот с щелочами. Первоначально образующиеся феноксиды обрабатывают сильными кислотами для получения свободных фенолов. Метод обычно применяют для получения многоатомных фенолов:
4.4 Получение из хлорбензола
Известно, что атом хлора прочно связан с бензольным кольцом, поэтому реакцию замены хлора на гидроксильную группу проводят в жестких условиях (300 °С, давление 200 МПа):
C6H5-Cl + NaOH – > C6H5-OH + NaCl
5. Применение фенолов
Раствор фенола используют в качестве дезинфицирующего средства (карболовая кислота). Двухатомные фенолы – пирокатехин, резорцин (рис. 3), а также гидрохинон (пара-дигидроксибензол) применяют как антисептики (антибактериальные обеззараживающие вещества), вводят в состав дубителей для кожи и меха, как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии.
В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – феноло-альдегидных смол, полиамидов, полиэпоксидов. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин, кроме того, красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений.
Мировое потребление фенола имеет следующую структуру:
· 44% фенола расходуется на производство бисфенола А, который, в свою очередь, используется для производства поликарбона и эпоксидных смол;
· 30% фенола расходуется на производство фенолформальдегидных смол;
· 12% фенола гидрированием превращается в циклогексанол, используемый для получения искусственных волокон – нейлона и капрона;
· остальные 14% расходуются на другие нужды, в том числе на производство антиоксидантов (ионол), неионогенных ПАВ – полиоксиэтилированных алкилфенолов (неонолы), других фенолов (крезолов), лекарственных препаратов (аспирин), антисептиков (ксероформа) и пестицидов.
· 1,4% фенола применяется в медицине (орасепт), как обезболивающее и антисептическое средство.
6. Токсические свойства
Фенол ядовит. Вызывает нарушение функций нервной системы. Пыль, пары и раствор фенола раздражают слизистые оболочки глаз, дыхательных путей, кожу (ПДК 5 мг/м³, в водоёмах 0,001 мг/л).
