Химические процессы в биологическом организме
К ним относится, прежде всего, способность белков подвергаться денатурации, т.е. претерпевать такие изменения пространственного строения, которые приводят к утрате или частичной потере функциональных свойств. Правда, денатурация во многих случаях обратима, однако эта обратимость не обеспечивается автоматически, а требует в каждом отдельном случае подбора специальных приемов. В то же время полностью или даже частично денатурированные белки весьма уязвимы для необратимых повреждений, в особенности для действия протеолитических ферментов, поэтому условий, способствующих денатурации, следует всемерно избегать.
Для предотвращения тепловой денатурации выделение белка проводят при низкой температуре, обычно при 4 °С. Необходимо также избегать крайних значений рН. Белки легко денатурируют при низких рН из-за протонирования отрицательно заряженных в нормальных условиях карбоксильных групп и возникающего вследствие этого резкого преобладания положительных зарядов, которое благоприятствует развертыванию компактной структуры. В щелочной среде при рН 10 и выше утрачиваются положительные заряды, обусловленные протонированием e-аминогрупп лизина, и опять-таки наступает декомпенсация зарядов на поверхности, дестабилизирующая глобулу.
10. Охарактеризуйте окислительное фосфорилирование на примере окислительного декарбоксилирования пировиноградной кислоты. Чем отличается окислительное фосфорилирование от фотосинтетического?
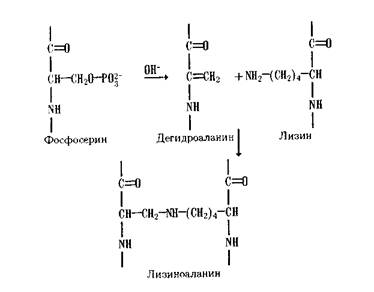
Фосфоролиз (от фосфор и греч. lysis - разрушение), ферментативная реакция расщепления химических связей в некоторых биологически важных соединениях с участием фосфорной кислоты; сопровождается включением фосфорильной группы (-Н2РО3) в образующиеся продукты. Ферменты, катализирующие реакцию, называются фосфорилазами. Они широко распространены в процессах обмена веществ у животных, растений и микроорганизмов. Фосфоролитическому расщеплению под действием ферментов могут подвергаться гликозидные (в гликогене), тиоэфирные (в ферментсубстратном комплексе, образующемся при окислении 3-фосфоглицеринового альдегида), углерод-углеродные (в ксилулозо-5-фосфате, в пировиноградной коферменте), фосфодиэфир-ные (в нуклеиновых к-тах) и углерод-азотные (в цитруллине) связи. Фосфоролиз играет важную роль в энергетике живых систем, т. к. фосфорильная группа, включённая в продукты реакции, под действием различных ферментов, в конечном счете, переносится на аденозиндифосфорную кислоту с образованием аденозинтрифосфорной кислоты (АТФ) - основного энергетического ресурса клеток.
В целом, реакция будет выглядеть следующим образом:
С6Н5СН = СН2 + 2РСl5 -> С6Н5СНС1 - СН2РСl4 • РСl5
11. Охарактеризуйте сходство и различие в действии соматотропина (гормона роста) и инсулина. Укажите, к какому классу относится каждый из них
Фосфорилирование по остаткам тирозина, которое катализируется специфическими протеинкиназами (тирозинкиназами), встречается значительно реже, чем фосфорилирование остатков серина и треонина - на долю фосфотирозина приходится около 0,1% всего связанного с белком фосфата. Однако биологическая роль этой реакции очень велика, так как она активно используется для передачи сигналов в биологических системах.
Так, инсулин, связываясь с рецептором - трансмембранным белком, вызывает активацию его домена, направленного в цитоплазму и являющегося тирозинкиназой. Тирозинкиназную активность индуцирует ряд факторов роста - белков, запускающих деление клеток по механизму, аналогичному описанному для инсулина. Рецепторы этих факторов, крупные трансмембранные белки - связывают их на наружной поверхности мембраны. Образование комплекса фактор рецептор передает сигнал через трансмембранную часть рецептора на его цитоплазматический домен, являющийся тирозинкиназой. Активированная таким образом тирозинкиназа модифицирует внутриклеточные белки, передавая сигнал далее.
Тирозинкиназы фосфорилируют остатки тирозина в некоторых внутриклеточных белках, вовлеченных в сложную систему регуляции клеточного деления, в которой также участвует и фосфорилирование белков по остаткам серина и треонина. Нарушение этой весьма сложной регуляторной сети может привести к неконтролируемому делению клеток, опухолевому росту. Характерно, что онкобелки, структурно близкие нормальным белкам животной клетки, но вызывающие ее трансформацию, превращение в опухолевую, нередко оказываются тирозин-киназами.
12. На примере превращений 3-фофоглицеринового альдегида покажите взаимосвязь углеводного и липидного обменов. Напишите уравнения реакций
По завершении биосинтеза полипептидной цепи С-концевой участок такого белка, содержащий от 17 до 31 остатка преимущественно гидрофобных аминокислот, отщепляется, заменяясь следующей структурой:
Белок—СО—NH—СН 2СН2O—гликан—глюкозамин—фосфоинозит—диацилглицерин Этаноламин.
Гликолипидный фрагмент несколько различен у разных белков, отличаясь строением гликана, содержащего галактозу, набором жирных кислот в диацилглицериновом звене, среди которых отмечено присутствие пальмитиновой и миристиновой кислот.
Весь гликолипидный фрагмент удается в некоторых случаях удалить при действии протеиназы. Связь между глюкозамином и фосфоинозитом расщепляется при действии азотистой кислоты. Особенно характерно отщепление липида при действии фосфолипаз D или С, которые гидролизуют соответственно фосфодиэфирные связи между инозитом и фосфатидовой кислотой или фосфоинозитом и диацилглицерином, что приводит к отделению белка от мембраны. Имеются сведения, что фосфолипаза С каким-то образом участвует в механизме действия инсулина, отщепляя гликолипидный фрагмент от липопротеинлипазы.
Используемая литература
1. Степанов В.М. Молекулярная химия. – М.: Высшая школа, 2002. – 329 с.
2. Ткачук А.Ф. Биохимия человека. – М.: Высшая школа, 2001. – 318 с.
3. Шатилов В. Р. Успехи биологической химии. – М.: Высшая школа, 1999. – 286 с.
