Химические реакции
4. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
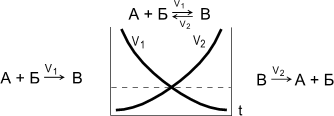
Обратимые реакции - химические реакции, протекающие одновременно в двух противоположных направлениях.
|
|
Химическое равновесие - состояние системы, в котором скорость прямой реакции (V1) равна скорости обратной реакции (V2). При химическом равновесии концентрации веществ остаются неизменными. Химическое равновесие имеет динамический характер: прямая и обратная реакции при равновесии не прекращаются.
Состояние химического равновесия количественно характеризуется константой равновесия, представляющей собой отношение констант прямой (K1) и обратной (K2) реакций.
Для реакции mA + nB « pC + dD константа равновесия равна
K = K1 / K2 = ([C]p • [D]d) / ([A]m • [B]n)
Константа равновесия зависит от температуры и природы реагирующих веществ. Чем больше константа равновесия, тем больше равновесие сдвинуто в сторону образования продуктов прямой реакции.
Способы смещения равновесия
Принцип Ле-Шателье. Если на систему, находящуюся в равновесии, производится внешнее воздействие (изменяются концентрация, температура, давление), то оно благоприятствует протеканию той из двух противоположных реакций, которая ослабляет это воздействие
| V1 | ||
| A + Б | « | В |
| V2 |
1. Давление. Увеличение давления (для газов) смещает равновесие в сторону реакции, ведущей к уменьшению объема (т.е. к образованию меньшего числа молекул).
| V1 | |||
| A + Б | « | В |
; увеличение P приводит к V1 > V2 |
| V2 | |||
| 2 | 1 |
2. Увеличение температуры смещает положение равновесия в сторону эндотермической реакции (т.е. в сторону реакции, протекающей с поглощением теплоты)
| V1 | ||
| A + Б | « |
В + Q, то увеличение t°C приводит к V2 > V1 |
| V2 |
| V1 | ||
| A + Б | « |
В - Q, то увеличение t°C приводит к V1 > V2 |
| V2 |
3. Увеличение концентрации исходных веществ и удаление продуктов из сферы реакции смещает равновесие в сторону прямой реакции. Увеличение концентраций исходных веществ [A] или [Б] или [А] и [Б]: V1 > V2.
4. Катализаторы не влияют на положение равновесия.
5. Гидролиза Гидролиз - это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита. (В общем случае обменное взаимодействие растворённого вещества с растворителем носит название - сольволиз). В большинстве случаев гидролиз сопровождается изменением pH раствора. Большинство реакций гидролиза - обратимы:
Pb(NO3)2 + H2O « Pb(OH)(NO3) + HNO3 Na2HPO4 + H2O « NaH2PO4 + NaOH Некоторые реакции гидролиза протекают необратимо:
Al2S3 + 6H2O « 2Al(OH)3¯ + 3H2S Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов. Способность солей подвергаться гидролизу зависит от двух факторов: 1) свойств ионов, образующих соль; 2) внешних факторов.
Отсутствие гидролиза в растворах Соли, образованные катионом сильного основания и анионом сильной кислоты (например, LiBr, K2SO4, NaClO4, BaCl , Ca(NO3)2 и др.) гидролизу не подвергаются, т.к. ни катион, ни анион соли не могут при взаимодействии с водой образовать молекулы слабых электролитов. Водные растворы таких солей имеют нейтральную реакцию среды (pH = 7). Практически не гидролизуются также и труднорастворимые соли (CaCO3, Mg3(PO4)2 и др.) из-за очень низкой концентрации ионов в водных растворах этих солей. Гидролиз по катиону Соли слабого основания и сильной кислоты гидролизуются по катиону:
NH4Cl + H2O « NH4OH + HCl
В ионной форме:
NH4+ + H2O « NH4OH + H+ Гидролиз солей, образованных многовалентным катионом протекает ступенчато, через стадии образования основных солей: 1 ступень:
Al(NO3)3 + H2O « Al(OH)(NO3)2 + HNO3 Al3+ + H2O « [Al(OH)]2+ + H+
2 ступень:
Al(OH)(NO3)2 + H2O « Al(OH)2(NO3) + HNO3 [Al(OH)]2+ + H2O « [Al(OH)2]+ + H+
3 ступень:
Al(OH)2(NO3) + H2O « Al(OH)3 + HNO3 [Al(OH)2]+ + H2O « Al(OH)3 + H+ Гидролиз протекает достаточно сильно по первой ступени, слабо - по второй ступени и совсем слабо - по третьей ступени (ввиду накопления ионов водорода, процесс смещается в сторону исходных веществ). Более полному гидролизу способствует разбавление раствора и повышение температуры. (В этом случае можно учитывать гидролиз и по третьей ступени.) При гидролизе по катиону реакция раствора кислая pH < 7.
Гидролиз по аниону Соли, образованные сильным основанием и слабой (ассоциированной) кислотой гидролизуются по аниону:
CH3COOK + H2O « CH3COOH + KOH
В ионной форме:
CH3COO- + H2O « CH3COOH +OH- Соли многоосновных кислот гидролизуются ступенчато (с образованием кислых солей): 1 ступень:
K2CO3 + H2O « KHCO3 + KOH CO2-3 + H2O « HCO3- + OH-