Химия цвета
Подобные соединения прямо могут служить неорганическими красителями — пигментами. В качестве красителей используются такие индивидуальные соединения, как, например, белила — оксид цинка или оксид титана (IV); чернь — это одно из аллотропных состояний углерода — сажа. Цвет может появиться лишь в том случае, если катион с подуровнями, заполненными электронами, связан с анионом, способным к значительной поляризации, например с тяжелыми ионами галогенов, таких, как Вг- или I-, некоторыми кислородсодержащими анионами PO43-, AsO43- и целым рядом других. Соли и оксиды металлов, имеющих атомы с незаполненными оболочками, в большинстве своем обладают окраской. Ионы металла имеют примерно тот же цвет, который присущ им в водном растворе: Си2+ — голубой, Сг3+ — зеленый и т. п. Существуют многочисленные анионы, способные придавать окраску ионам, особенно если это ионы металлов побочных подгрупп. Так, например, желтый анион CrO42- влияет на бесцветный катион серебра Ag+, что в результате реакции:
2Ag+ + CrO42- → Ag2CrO4
образуется красный осадок хромата серебра. В подобной же реакции бесцветный ион ртути Hg2+ образует оранжевое соединение HgCrO4. Однако, ион свинца — металла главной подгруппы IV группы, соединяясь с CrO42-, так и оставляет желтым цвет хромата свинца РbСгO4.
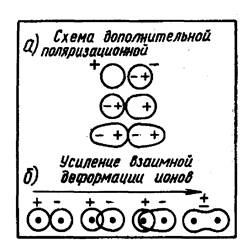
Рис. 10. Возникновение поляризационного эффекта (а) и усиление (б) взаимной деформации ионов.
Взаимное влияние катионов и анионов позволяет варьировать оттенки цвета.
Поэтому чаще всего применяются соединения переменного состава: желтый крон — смесь хрома и сульфата свинца РbСгO4 • nРbSO4, изумрудная зелень - гидроксид хрома переменного состава Сг203 • nН2O (n= 1,5—2,5), кобальт светло-фиолетовый и фиолетовый — фосфаты кобальта, гидратированные водой Соз(РО4)2 • 8Н2О или СоNH4PО4.
Таким образом, окраска полярной молекулы зависит от наличия у катиона свободных электронных подуровней, от способности катиона поляризовать анион и соответственно от способности этого аниона к поляризации.
Связь цвети вещества с положением элементов в периодической системе
Напомним, что существуют s-, р-, d- и f-элементы. Каждый из этих типов имеет свои особенности при образовании соединений. Появляющиеся продукты не всегда обладают цветом, в ряде случаев они бесцветные или белые.
Не имеют окраски неорганические вещества, молекулы которых образованы s- и р-элементами и имеют ионы с заполненными электронами оболочками: катионы щелочных и щелочноземельных металлов, анионы неметаллов первых трех периодов. К ним примыкают соединения (в основном оксиды) элементов, расположенных в периодической системе Д. И. Менделеева на условной границе металл — неметалл: сурьмы, висмута, свинца, алюминия. Из побочных подгрупп белый цвет имеют соединения элементов IV группы (переходные металлы): титан и цирконий. Причем цирконий, как более металлический элемент, входит в состав веществ только в виде катиона Zr4+, а титан и как катион, и в составе аниона. Широко применяются в качестве белых пигментов соли титановой кислоты; титанаты магния, кальция, бария и некоторых других элементов. Состав этих соединений таков, что у кислорода и катионов элементов II группы нельзя перевести электрон из основного в возбужденное состояние, так как нет свободных орбиталей, куда могли бы перейти электроны, запасшиеся энергией от светового кванта. У титана же и циркония слишком велика разница в величинах энергии между заполненными подуровнями и вакантными. У квантов видимого света просто не хватает энергии для возбуждения электронов.
Ионы, имеющие незавершенные оболочки, в большинстве случаев образуют окрашенные соединения. При этом, если анион не способен к сильной поляризации, то цвет вещества определяется катионом и соответствует окраске катиона в водном. растворе: железа — желтой, меди — голубой и др.
У d-элементов IV периода цвет соединений определяется переходами электронов с одной d-орбитали на другую и переносом заряда на ион металла. Затягивая электроны с орбиталей аниона, на вакантные орбитали своих атомов, катионы хрома, марганца, железа, кобальта, никеля и некоторых других металлов придают соответствующую окраску всем своим соединениям. Этим же объясняется окраска ряда оксидов элементов с переходными свойствами (металлов).
Необходимо, однако, заметить, что появление возможности того или иного перехода определяется влиянием атомов, с которыми соприкасается атом данного d-элемента. Пять d-орбиталей занимают в молекуле несколько иное положение, чем в свободном атоме. Разница в энергиях этих орбиталей как раз соответствует энергии квантов видимой части электромагнитного излучения и обусловливает цвет вещества, содержащего ионы Gr3+, Fe2+, Fe3+, Co2+, Ni2+, Mn4+, Mn7+. Цвет некоторых веществ, например оксида железа (III) Fe2O3 и гидроксида железа (III) Fe(OH)3, определяется сразу двумя обстоятельствами: электронными переходами с одной d-орбитали на другую и переносом заряда с аниона на катион.
Потенциалы переноса заряда зависят от межатомных, межионных, межядерных расстояний. Следовательно, и в соединениях d-элементов большую роль играет деформируемость катиона и аниона.
Элементы больших периодов, расположенные внизу групп элементов, деформируются легко. Особенно если у них имеется много внутренних незавершенных слоев или 18-электронные оболочки. Это относится как к катионам металлов, так и к анионам неметаллов. Примером, подтверждающим такое поведение, может служить взаимное влияние ионов свинца Рb2+ и иода I-. Оба они в водном растворе бесцветны и раствор иодида свинца тоже не имеет окраски.
Когда же из раствора начинает выделяться осадок этого соединения, то ионы cсближаются друг с другом и выпадает красивый золотисто-желтый осадок кристаллов РbI2. Здесь и катион и анион легко деформируются и происходит взаимная поляризация. Если ион сильно деформирует оболочку соседа, то говорят о его сильном поляризующем действии.
Росту деформируемости способствует увеличение радиуса иона и уменьшение положительного заряда ядра. Так как эти величины предсказуемы на основании периодического закона Д. И. Менделеева, то в принципе можно прогнозировать наличие цвета у того или иного соединения, составленного из каких-либо конкретных анионов и катионов. Возникновение цвета у оксида элемента и отсутствие окраски у фторида возможно потому, что кислородный ион поляризуется легче, чем ион фтора, так как у него меньше положительный заряд ядра и больше радиус. Анион серы деформируется еще легче, потому что у него больше внутренних электронных слоев и есть {правда, совсем пустые) d-орбитали, которые он использует при образовании химических связей. Однако катионы цинка Zn2+, алюминия Al3+ и кремния Si4+, несмотря на довольно большие радиусы, не способны к деформациям, так как у них велик заряд иона.
Разноцветные ионы одного металла
Известно, что цвет большинства неорганических соединений определяется состоянием окисления входящих в него ионов. Этим широко пользуются в аналитической химии. Возможности изменения цвета обусловлены как различным состоянием электронов в зависимости от степени окисления, так и изменением поляризующего действия этих ионов.
