Электросинтез хлорной кислоты
При очень высоких требованиях к чистоте хлорной кислоты последнюю можно дополнительно очищать от примесей НС1 отгонкой или отдувкой соляной кислоты инертным газом. Для очистки хлорной кислоты, получаемой из электролизеров продукционной стадии, от соляной кислоты можно применять также ректификацию. При этом отпадают трудности, связанные с электрохимической очисткой, и достигается более высокий суммарный выход хлорной кислоты по току. Хлористый водород, отгоняемый из хлорной кислоты при ректификации, можно вновь возвратить на стадию продукционного электролиза.
Хлорную кислоту можно получать также анодным окислением хлора, растворенного в электролите — в 4—6 н. растворе хлорной кислоты . При электролизе таких растворов на платиновых анодах и серебряных катодах электролизеры, рассчитанные на нагрузку 3,5 кА при плотности тока 2 кА/м2 и температуре О °С, работали при напряжении 4 В. Процесс описывается суммарным выражением
СL2 + 8Н20 — 2 НСLO4 + 7 Н2 (2)
По этому методу может быть получена очень чистая кислота, поскольку со стороны не вводятся никакие загрязняющие примеси. Часть электролита отбирают и после перегонки получают 60—70%-ную товарную кислоту.
Для электрохимического получения хлорной кислоты применяют электролизеры с платиновыми или платино-титановыми анодами . Вследствие очень высокой коррозионной активности смесей хлорной и соляной кислоты в качестве катода часто применяют графит. Графитовые катоды легко выдерживают остановки, связанные со снятием катодной поляризации. Известно, что при анодной поляризации платины в не сильно разбавленных растворах соляной кислоты при потенциалах отрицательнее 1,1—1,2 В (против н. в. э) происходит анодное растворение платины с выходом по току, близким к 100%. В этих условиях скорость растворения платины увеличивается с ростом потенциала, кислотности раствора и температуры. При потенциале платины (в анодную сторону) выше 1,1—1,2В наблюдается пассивация платины и при потенциале 1,3В в 1 н. НС1 скорость растворения платины снижается до 4•10-5A/м2
Пассивация поверхности платинового анода, наблюдаемая в процессе электрохимического получения хлорной кислоты, связана с образованием на поверхности слоев адсорбированного кислорода и фазовых оксидов различного состава. Структура оксидных слоев на поверхности платины и ее коррозионная стойкость зависят от соотношения концентраций НС104 ,и НС1 в электролите. В процессе электролиза соляной кислоты с целью получения хлора и водорода добавление к электролиту 50—150 г/л хлорной кислоты снижает скорость анодного растворения платины. При электролизе чистых растворов НС104 кислород связан с поверхностью платины более прочно, чем при электролизе смесей НС104 и НС1
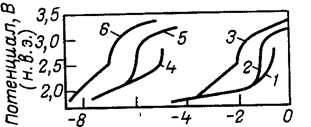
На рис. 5 приведена зависимость плотности общего тока поляризации на платиновом аноде и плотности тока растворения платины от потенциала анода при электролизе 3 н. НС104 при различных температурах .
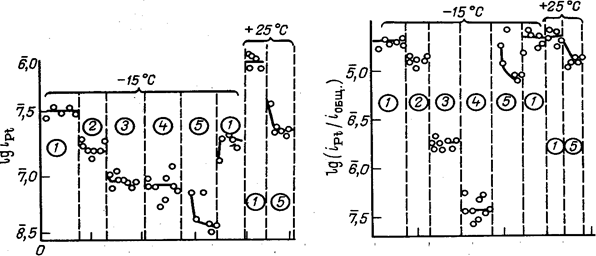
С увеличением содержания НС1 в электролите количество фазовых оксидов на поверхности анода уменьшается. В процессе электролиза смесей НС104 и НС1 при высоких анодных потенциалах и постоянной суммарной кислотности увеличение содержания НС1 в электролите или растворение элементарного хлора приводит к повышению коррозионной стойкости платинового анода . Как при комнатной, так и при пониженной температуре, увеличение содержания НС1 в электролите или насыщение его элементарным хлором приводит к снижению плотности тока растворения платины. Результаты исследований, проведенных при температурах —15 и —25 °С и потенциале 2,8В (н.в.э.), приведены на рис. 6.
На рис. 7 приведена зависимость доли тока, расходуемого на растворение платины, от концентрации НС1 в электролите или от насыщения электролита хлором для тех же условий электролиза.
При увеличении концентрации НС1 плотность тока растворения платины и доля тока, расходуемого на ее растворение, снижаются, особенно сильно при введении первых порций НС1 в электролит. Поэтому при выборе условий электрохимического производства хлорной кислоты целесообразно применять верхний предел концентрации НС1, при котором еще не наблюдается существенного снижения выхода хлорной кислоты по току. С понижением температуры электролиза, эта наиболее целесообразная концентрация НС1 в электролите возрастает .
Насыщение электролита элементарным хлором снижает плотность тока растворения платины, но мало влияет на долю тока, расходуемого на растворение, так как практически в равной мере снижаются скорости основных анодных процессов и общая плотность поляризующего тока .
Ранее для изготовления анодов применяли платиновые проволоки или фольгу. В настоящее время используются платино-титановые аноды, в которых платина в виде тонкой фольги приваривается к титановой основе электрода При длительном электролизе происходит постепенное разрушение платино-титановых анодов, как за счет растворения платины на работающей поверхности анода, так и вследствие нарушения контакта между платиновой фольгой и титановой основой. При этом платина, перешедшая в раствор, частично осаждается на графитовых катодах; остальная ее часть выводится из электролизера с потоком хлорной кислоты. Платина осаждается в поверхностном слое графитового катода толщиной не более 100 мкм.
При включении нового электролизера со свежими графитовыми катодами содержание платины в хлорной кислоте, отбираемой из электролизера, составляет 0,3—0,5 мг/л, но по мере отложения платины на поверхности графитового катода условия осаждения ее на катоде изменяются. Скорость осаждения платины на катоде снижается. Это приводит к уменьшению осаждения платины из
|
|
lg j,A/см2
Рис. 5. Влияние потенциала на скорость суммарного анодного процесса (/—3) и скорость растворения платины 4—6 в 3 н. Н НС104 при различной температуре:
1,4—при 57 °С: 2,5—при 25 0С; 3.5 — при —180С.
|
400 800 1200 1600 2000 0 400 800 1200 1600 2000 Время, мин Время, мин |
|
Рис. 6. Скорость растворения платины в электролитах разного состава (в н.): 1—ЗНС104 ; 2—ЗНС104 +0.01НС1; 3- 2,9НС104 + 0.1НС1; 4—2НС104 + 1НС1; 5—ЗНС104 .насыщенный С12 |
Рис. 7. Доля тока, расходуемого на растворение платины в электролитах разного состава (обозначения те же, что и на рис. 6). |
раствора на катоде к постепенному возрастанию содержания платины в растворе, вытекающем из электролизера, до 2—2,5 мг/л .Стационарная концентрация платины в электролите зависит также от его состава и несколько возрастает с увеличением концентрации НС104 в интервале от 300 до 600 г/л и концентрации НС1 в интервале от 0 до 30 г/л.