Электросинтез хлорной кислоты
|
|
|
|
|
Рис. 7. Зависимость равновесной концентрации платины от содержания НС104 в электролите (концентрация НС1 16—18г/л, содержание Pt на графите 9,9 мг/см2, температура 24—26 °С). |
Рис. 8. Зависимость равновесной концентрации платины от содержания НС1 в каталите (концентрация НС104 423—433 г/л, содержание платины на графите 9,0 мг/см2, 24—26°С). |
На рис. 7 и 8 показано изменение количества платины в катодном пространстве, отделенном малопроточной диафрагмой от анодного пространства, через 5—7 ч электролиза при начальном содержании ее в катодной жидкости 6,8 мг/л. Повышение содержания НС1 и НС104 в электролите в исследованных пределах приводит к снижению скорости осаждения платины на графите и увеличению остаточного содержания ее в жидкости в 1,3—1,5 раза .Платина, осажденная на катоде, может быть собрана и возвращена на регенерацию; платина, уносимая из электролизера с потоком хлорной кислоты, теряется безвозвратно.
При определенных условиях процесса наиболее уязвимым в платино-титановых электродах является место приварки платиновой фольги к титановой основе электрода. В этом месте образуются сплавы платины с титаном переменного состава, которые отличаются меньшей коррозионной стойкостью, чем платина.
В качестве основы анода может быть использован также тантал. При испытаниях платино-танталовых анодов, полученных нанесением платины на танталовую основу электрода электроискровым способом, при потенциалах 3,0—3,1 В и комнатной температуре полученные электрохимические показатели аналогичны показателям на платино-титановых анодах. При температуре —20 °С выход хлорной кислоты и хлора по току несколько ниже, а кислорода выше, чем на платино-титановом аноде. Это, по-видимому, можно объяснить образованием платино-танталовых сплавов на поверхности анода при нанесении платины электроискровым способом
Для получения хлорной кислоты в качестве анода могут быть использованы и другие металлы платиновой группы. Электролиз смешанных растворов НС104 и НС1 (содержание НС1 1 н.) предложено проводить на иридиевом аноде в интервале (—5)—(—30) °С при анодном потенциале 2,9—3,3 В, а также на родиевом аноде. Однако в промышленных условиях обычно применяются пла-тино-титановые аноды.
5.ТЕХНОЛОГИЧЕСКАЯ СХЕМА ПРОИЗВОДСТВА.
Технологическая схема производства хлорной кислоты включает следующие основные стадии: приготовление электролита, электролиз, вакуумная дистилляция и получение безводной кислоты.
Содержание примесей в хлорной кислоте зависит от чистоты исходной хлороводородной кислоты, а также от типа конструкционных материалов электролизеров, трубопроводов и вспомогательной аппаратуры. С целью уменьшения содержания ионов хлорида в получаемой хлорной кислоте обычно используют каскад электролизеров, в котором осуществляется более полное окисление хлорид-ионов до НСLO4.
При получении хлорной кислоты путем анодного окисления хлора удается обеспечить очень высокое качество НСLO4, так как с хлором в электролит не вводится никаких примесей.
На стадии приготовления электролита часть хлорной кислоты, полученной в результате электролиза, из сборника насосом перекачивают в холодильник, в котором с помощью охлаждающего рассола понижают ее температуру до —5 "С. После охлаждения хлорную кислоту направляют в абсорбер, в который также подают хлор. В абсорбере осуществляют насыщение раствора хлорной кислоты хлором. Раствор, содержащий 40% (масс.) НСLO4 и около 3 кг/м3 растворенного хлора, с температурой О °С выводят из абсорбера и подают на электролиз. Из электролизера через промежуточный сборник выводят раствор хлорной кислоты, содержащей незначительное количество хлора и хлористого водорода, и направляют на вакуумную дистилляцию. В процессе дистилляции при давлении 2,66—3,23 кПа отгоняются пары воды, хлор и хлорид водорода. Отогнанные пары конденсируют в холодильнике и возвращают в сборник на стадию приготовления электролита.
Полученную хлорную кислоту с температурой около 90 °С направляют в холодильник и далее через вакуумный приемник в виде 60—70%-го раствора подают в сборник готового продукта.
При получении безводной хлорной кислоты используют процесс обезвоживания раствора хлорной кислоты олеумом с вакуумной отгонкой НСLO4 в обогреваемом аппарате из кварцевого песка.
6. КОНСТРУКЦИИ ЭЛЕКТРОЛИЗЕРОВ.
В литературе имеется мало публикаций о конструкциях современных электролизеров
Известно, что используются в основном монополярные ящичные электролизеры с платино-титановыми анодами и графитовыми катодами. При применении электролизеров без диафрагмы выделяющийся на катоде водород загрязняется хлором и кислородом в количествах, превышающих взрывобезопасные пределы. В этом случае газы в электролизере следует разбавлять инертными газами.
При использовании электролизеров с диафрагмой их конструкция усложняется, а напряжение на электролизере возрастает. Однако вследствие разделения анодного и катодного пространств получаемые водород и хлор достаточно чистые и могут быть использованы; облегчаются создание безопасных условий работы и защита окружающей среды от вредных газовых выбросов.
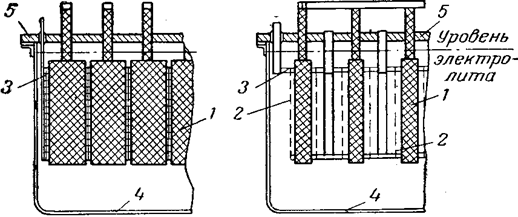
Рис. 8 Хлоратный электролизер Ангела:
1 — графитовые аноды; 2 — катоды; 3 — катодная рама;
4 — корпус электролизера; 5 — крышка.
Сообщается о применении для получения хлорной кислоты электролизеров фильтр-прессного типа с биполярным включением электродов. Рамы электролизера, изготовленные из поливинилхлорида, снабжены диафрагмой из сетки, выполненной из полимерных материалов. Аноды покрыты платиновой фольгой, катоды — серебряные. Электролизер на нагрузку 5 кА работал при плотности тока 2,5 кА/м и напряжении на ячейке 4,4 В; выход по току составил около 60%.
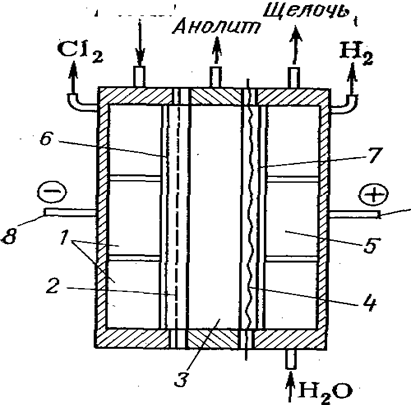
Предложено также получать хлорную кислоту анодным окислением водных растворов хлоратов в трехкамерном электролизере (рис. 9)с двумя ионообменными мембранами. При применении платиновых или платино-титановых анодов в анодном пространстве можно получить достаточно чистую 2 н. кислоту, а в катодном пространстве — раствор щелочи. При этом в качестве катода можно использовать обычную сталь.
Хотя хлорная кислота, полученная электрохимическим окислением растворов НС1 или С12 в НС104, используется для производства различных перхлоратов, часто с успехом применяется также и обратный процесс — получение хлорной кислоты из перхлоратов щелочных или щелочноземельных металлов. В этом случае исходным сырьем обычно служит перхлорат натрия, получаемый электрохимическим окислением хлората натрия. Иногда перхлорат
 |


