Взаимосвязь физики и химии в процессе преподавания физики в полной средней школе
При изучении в X классе взаимодействия атомов и молекул, а также физических свойств твердых тел и жидкостей следует уделить особое внимание видам химической связи, известным учащимся из курса химии VIII классе, т.к. этот материал в дальнейшем используется при изучении проводников и диэлектриков, электрического тока в газах, жидкостях и металлах при изучении электрических свойств полупроводников и других вопросов курса физики.
Причем изложение видов химической связи на уроках физики должно быть не простым повторением изученного в химии, а определенным дополнением и углублением знаний учащихся в этой области.
Практика работы показала, что понятие Ван-дер-Ваальсовой, ионной и металлической связи можно дать учащийся VIII класса при изучении взаимодействия молекул и на основе полученных представлений о видах связи (включая и ковалентную связь, известную учащимся из курса химии) раскрыть содержание разделов, касающихся строения и свойств твердого тела и жидкости. К этому времени учащимся уже известно строение атомов элементов малых и больших периодов, электростатическое взаимодействие одноименных и разноименных зарядов, поэтому объяснение видов связи на основе современных представлений о строении атома не вызывает существенных затруднений.
Для уточнения понятия об энергии взаимодействия молекул желательно вернуться к вопросу об ионной связи при изучении закона Кулона в IX классе. Сила связи может быть определена по формуле закона Кулона:
|
|
![]()
где l - заряд электрона.
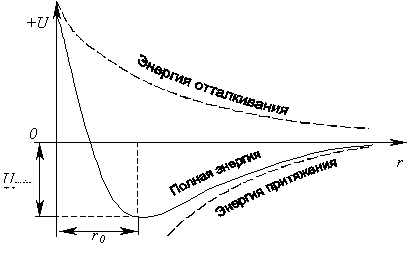
При уменьшении расстояния r между ионами сила взаимодействия возрастает по абсолютной величине, и при этом должна также возрастать энергия притяжения, но при определенное значении r начинают действовать силы отталкивания, причина которых заключается в электростатическом взаимодействии следующих электронных оболочек атомов. Эти силы быстро возрастают, и при некотором значении r0 устанавливается равновесное состояние ионов. Энергия взаимодействия в этом случае минимальна, что соответствует устойчивому состоянию образовавшейся молекулы. Это легко поясняется графиком на рисунке.
На основе понятия об ионной связи можно познакомить учащихся со строением ионных кристаллов, объяснить их физические свойства.
Достаточно глубокое объяснение причин возникновения ковалентной связи является трудной задачей, так как для этого необходимо знание квантовой теории строения атома. Однако, учитывая важность этого вида связи, целесообразно использовать имеющиеся в учебнике химии VIII класса объяснение ковалентной связи на основе моделей электронных облаков в атомах. Здесь же в параграфе «Атомные и молекулярные решетки» преподаватель физики найдет ценный иллюстративный материал для объяснения физических свойств веществ с атомными кристаллическими решетками. Помимо названных видов связи, желательно познакомить учащихся, хотя бы в общих чертах, с металлической связью.
В металлических телах существует связь, отличная от ионной и ковалентной, получившая название металлической. Учащимся известно, что валентные электроны в атомах металла связаны с ядром относительно слабо. А атомы металла в твердом состоянии тела располагаются настолько близко, что валентные электроны приобретают способность покидать атом и свободно перемещаться, распределяясь равномерно по всему объему металла. Образовавшиеся положительные ионы металла стягиваются блуждающими между ними электронами.
В заключение полезно познакомить учащихся с таблицей зависимости физических свойств вещества от типа кристаллической решетки.
Таблица 2
|
Тип кристалла |
Свойства вещества |
Структурные единицы |
Тип связи |
Примеры | ||||||
|
Молекулярные кристаллы |
Мягкие, низкая температура плавления, растворимы в органических жидкостях. |
Молекулы |
Ван-дер-Ваальсовы силы |
Йод, лед | ||||||
|
Металлические |
Твердые, высокая температура плавления, тягучие, ковкие, высокая электротеплопроводность, металлический блеск, растворимы только в жидких металлах. |
Ионы металлов |
Металлическая связь |
Медь и другие металлы | ||||||
|
Ионные кристаллы |
Твердые и упругие, высокая температура плавления, растворимы в ионизирующих растворителях типа воды или нерастворимы. Растворы или расплавы проводят электрический ток |
Положительные и отрицательные ионы |
Электростатическая ионная связь |
Хлористый натрий | ||||||
|
Атомные кристаллы |
Твердые, высокая температура плавленая, нерастворимы практически ни в каких растворителях |
Атомы |
Ковалентная связь |
Алмаз, карборунд | ||||||
Изложение видов химической связи на уроках физики на основе сведений, известных учащимся из химии, позволяет значительно расширить знания учащихся о внутреннем строении физического тела, объяснить зависимость физическая свойств от его структуры.
Помимо использования данных химии на уроках физики мы также вводим такую форму межъядерной связи, при которой учитель химии обращает особое внимание на те вопросы своего курса, которые имеют непосредственное отношение к молекулярной физике. Задача заключалась в том, чтобы на уроках химии была отражена физическая сущность ряда предусмотренных программой физико-химических процессов. Не говоря о значении такой взаимосвязи для курса химии она позволяет в известной мере дополнить знания учащихся по молекулярной физике.