Адсорбция ионных и неионных поверхностно-активных веществ
Содержание
1. Адсорбция ПАВ на гидрофобных поверхностях
1.1 Ионные ПАВ
1.2 Неионные ПАВ
2. Адсорбция ПАВ на гидрофильных поверхностях
2.1 Ионные ПАВ
2.2 Неионные ПАВ
3. Конкурентная адсорбция: распространенность явления
3.1 Смеси анионных и катионных ПАВ
3.2 Смеси анионных и неионных ПАВ
3.3 Смесь двух неионных ПАВ
3.4 Смеси анионного ПАВ и полимера
1. Адсорбция ПАВ на гидрофобных поверхностях
1.1 Ионные ПАВ
На рис.1 показаны кривые адсорбции гомологов жирных кислот на угле из водных растворов. Адсорбция увеличивается по мере роста КПУ ПАВ.
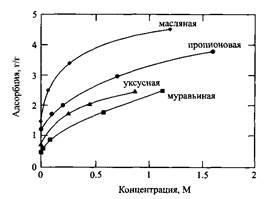
Рис.1. Адсорбция жирных кислот на угле из водных растворов
На рис.2, приводит к повышению адсорбции. Введение соли уменьшает электростатическое отталкивание между молекулами ПАВ на поверхности, обеспечивая более плотную упаковку молекул и уменьшает эффективную площадь поперечного сечения полярной группы. Было установлено, что площадь поперечного сечения А, приходящаяся на молекулу ПАВ, зависит от концентрации соли.
Как отмечалось выше, адсорбция ПАВ сравнительно мало чувствительна к полярности поверхности. На рис.3 показана зависимость площади поперечного сечения молекулы ПАВ при максимальной адсорбции от полярности латексных частиц. Из рисунка видно, что при переходе от самого неполярного поливинилхлорида к самому полярному поливинилацетату площадь поперечного сечения ПАВ, а следовательно и величина адсорбции, изменяется только в ~2 раза.
1.2 Неионные ПАВ
В случае неионных ПАВ адсорбция, кроме того, зависит от свойств растворов, т.е. от КПУ. На рис.4, а приведены изотермы адсорбции на двух латексах для трех неионных ПАВ - нонилфенолов с 10,20 и 50 оксиэтиленовыми группами.
![]()
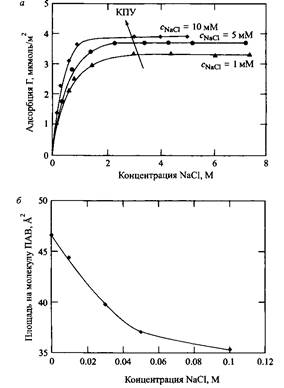
Рис.2. Адсорбция ДСН при трех различных концентрациях хлорида натрия: а - адсорбция увеличивается с увеличением КПУ, б - площадь поперечного сечения, приходящегося на полярную группу уменьшается с увеличением КПУ
Прежде всего можно отметить значительную разницу в адсорбции трех НПАВ, причем в наибольшей степени адсорбируется ПАВ с самой короткой полиоксиэтиленовой цепью. Далее отметим совсем небольшую разницу в адсорбции НПАВ на двух латексных поверхностях: на более полярной поверхности полиметилметакрилата адсорбция несколько меньше. Повышенная адсорбция НПАВ с более короткими полиоксиэтиленовыми цепями согласуется с представлениями о том, что КПУ увеличивается, по мере того как полиоксиэтиленовые цепи становятся короче. При увеличении КПУ молекулы ПАВ плотнее упаковываются на поверхности. Адсорбция достигает плато при концентрации ПАВ в растворе, слегка превышающей ККМ. Небольшие стрелки на рис.4 показывают KKM НПАВ.
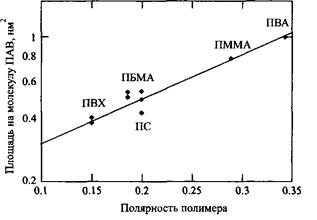
Рис.3. Зависимость площади на молекулу ПАВ при максимальной адсорбции от полярности полимерного латекса
В таблице 1 представлены результаты анализа изотерм адсорбции в рамках уравнения Ленгмюра для данных НПАВ, для сравнения приведены аналогичные данные для додецилсульфата натрия. Видно, что площадь поперечного сечения на молекулу ПАВ увеличивается при увеличении длины полиоксиэтиленовой цепи. Свободная энергия Гиббса адсорбции уменьшается с длиной полиэтиленовой цепи, хотя ее величина для НПАВ остается выше, чем в случае ДСН.
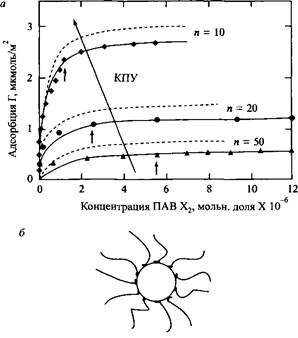
Рис.4. а - Изотермы адсорбции НС-Е„ на полистирольном латексе и на полиметилметакрилатном латексе; б-упрощенная модель адсорбции НПАВ на частицах латексов, в которой углеводородные цепи молекул НПАВ находятся в контакте с поверхностью, а полиоксиэтиленовые группы направлены в водную фазу. С разрешения Academic Press
Из таблицы 1 и рис.4 можно сделать следующие выводы. Свободная энергия Гиббса адсорбции неионных ПАВ типа NP-Ew зависит от длины полиоксиэтиленовой цепи. Таким образом, в смеси НПАВ должен проявляться хроматографический эффект: НПАВ с короткими полиоксиэтиленовыми цепями преимущественно адсорбируются на гидрофобных поверхностях. Поэтому при использовании партии техническою ПАВ молекулы с длинными оксиэтиленовыми цепями остаются в растворе, а гомологи с короткими цепями находятся на поверхностях, имеющихся в системе. На рис.5 показаны в качестве примера результаты расчета для системы, состоящей из смеси NP-Eio и NP-E20, причем составы партий обоих НПАВ подчиняются распределению Пуассона. Поверхность обогащается молекулами НПАВ с короткими полиоксиэтиленовыми цепями, в то время как раствор обогащен гомологами с длинными полиоксиэтиленовыми цепями.
Из таблицы 1 также видно, что НПАВ адсорбируются сильнее, чем анионный додецилсульфат натрия, вследствие отсутствия электростатического отталкивания между молекулами на поверхности. Значения KKM НПАВ обычно в 10-100 раз ниже KKM ионных ПАВ при одинаковой длине углеводородных радикалов.
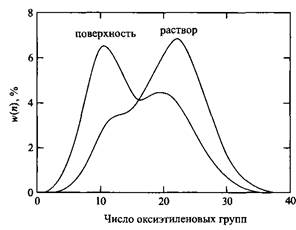
Рис.5. Рассчитанные нормализованные кривые распределения смеси НПАВ, адсорбированной на латексе и в находящемся в равновесии растворе
Из модели адсорбции, приведенной на рис.4 можно прийти к неверному выводу о том, что свободная энергия адсорбции не зависит от длины полиоксиэтиленовых цепей НПАВ, поскольку она определяется только контактами между углеводородными частями молекулы ПАВ и поверхностью. Но, как видно из табл.1, свободная энергия Гиббса адсорбции уменьшается при возрастании длины полиоксиэтиленовой цепи. Это объясняется увеличением размера молекул ПАВ с ростом длины полиоксиэтиленовой цепи. Однако этот факт не учитывается при анализе изотерм адсорбции в рамках уравнения Ленгмюра. Для разработки более реалистичной модели адсорбции ПАВ необходимо учитывать два дополнительных фактора: во-первых, разницу размеров молекул ПАВ, во-вторых, взаимодействие между ними. В таблице 2 представлены результаты такого анализа адсорбции НПАВ на частицах полистирольного латекса. Из приведенных данных можно заключить, что существуют две движущие силы адсорбции: взаимодействия углеводородных фрагментов ПАВ с поверхностью и взаимодействие этих фрагментов молекул ПАВ между собой. Строго говоря, ад сорбцию определяет изменение взаимодействий: первый вклад связан с заменой молекулярных контактов поверхность-вода на контакты поверхность-углеводородные цепи молекул ПАВ; второй вклад связан с заменой контактов молекулы воды-углеводородные фрагменты молекул ПАВ на контакты углеводородных фагментов друг с другом. Второй вклад в энергию адсорбции НПАВ гораздо больше первого; по своей природе эта энергия близка к энергии мицеллообразования. Значит, свободная энергия адсорбции Гиббса практически равна свободной энергии мицеллообразования.
Таблица 2. Два вклада в энергию адсорбции НПАВ на поверхности частиц полистирольного латекса
|
ПАВ |
Взаимодействие ПАВ-поверхность |
Взаимодействие ПАВ-ПАВ |
|
NP-E10 |
1.6 |
5±2 |
|
NP-E20 |
1.6 |
7±2 |
|
NP-E50 |
1.6 |
6±2 |
