Аффинность антител и кинетика реакций
Методы тушения биолюминесценции основаны на использовании в качестве маркера АТР, пришитой к' молекуле антигена. В составе такого комплекса молекула АТР сохраняет активность в реакции биолюминесценции, катализируемой светлячковой люциферазой. При добавлении антител образуется комплекс с антигеном, в котором молекула АТР становится недоступной ферменту, в результате чего ингибируется реакция биолюминесценции. Указанный метод обладает высокой чувствительностью, что позволяет измерять константы ассоциации до 10-12 М.
Перечень экспериментальных методов определения аффинности взаимодействия антиген — антитело приведен в табл. 1.
2. Способы расчета констант комплексообразования реакции антиген — антитело
Взаимодействие одной субпопуляции антител с моновалентным антигеном. Этот наиболее простой случай реализуется, например, при связывании гаптена с Fab-фрагмента-ми моноклональных антител и описывается простейшей схемой.
Из системы уравнений материального баланса
![]()
с учетом для константы равновесия комплексообразования можно легко получить выражения равновесной концентраций образовавшегося комплекса
![]()
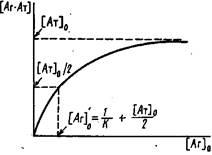
1. Один из часто используемых способов расчета константы состоит в исследовании зависимости образующегося комплекса от общей концентрации антигена о. Если при достаточно больших концентрациях антигена в системе выполняется условие, то принимает вид
![]()
Эта зависимость является аналогом изотермы адсорбции Лэнгмюра в теории адсорбции или уравнения Михаэлиса-Ментеи в ферментативной кинетике. Из выражения следует, что при предельных значениях концентрации 0 концентрация комплекса стремится к общей концентрации центров связывания 0. Для вычисления К определяют концентрацию антигена 'о, при которой половина антител находится в виде комплекса с антигеном. С учетом выражений и можно получить
![]()
Из выражения следует, что '0 = 1/К при условии 1/К">о. При обратном соотношении данный метод определения К неприемлем.
Зависимость концентрации образующегося комплекса от общей концентрации антигена в растворе
Графическое определение константы связывания в двойных обратных координатах
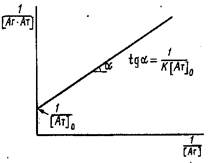
2. Иногда для вычисления константы связывания К используют представление экспериментальных данных зависимости концентрации комплекса от концентрации свободного антигена в системе двойных обратных координат:
![]()
При постоянной концентрации антител в системе варьируют начальную концентрацию антигена и в условиях равновесия определяют концентрацию свободного и связанного в комплекс антигена. График в двойных обратных координатах представляет собой прямую линию с тангенсом угла наклона, отсекающую на оси ординат отрезок ![]()
В условиях избытка антигена анализ проводят в координатах 1/0.
3. Наиболее часто для анализа комплексообразования используют метод Скэтчарда, основанный на исследовании зависимости отношения равновесной концентрации комплекса к концентрации свободного антигена от концентрации комплекса.
Аналитический вид уравнения Скэтчарда легко получить из выражения для константы комплексообразования и уравнения материального баланса:
![]()
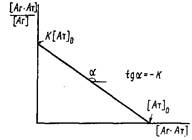
В литературе часто эти координаты обозначают в символах.B/F-i-B. Зависимость Скэтчарда имеет вид прямой с тангенсом угла наклона — К, отсекающей на оси ординат отрезок К о, а на оси абсцисс 0. Графическая обработка экспериментальных данных в координатах Скэтчарда позволяет вычислить не только равновесную константу связывания, но и концентрацию активных центров антител 0 в системе.
На практике при нахождении константы данным способом проводят серию опытов по определению равновесной концентрации свободного антигена при различных начальных концентрациях антигена и постоянной концентрации антител в системе.
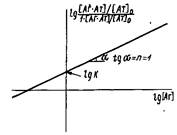
4. В качестве еще одного преобразования уравнений и используют следующее:
![]()
Разделив числитель и знаменатель части равенства на концентрацию антител 0 и логарифмируя выражение, получаем
![]()
В координатах![]() , называемых координатами Хилла, должна получаться прямая с тангенсом угла наклона, равным единице, пересекающая ось ординат в точке IgK.
, называемых координатами Хилла, должна получаться прямая с тангенсом угла наклона, равным единице, пересекающая ось ординат в точке IgK.
Взаимодействие одной субпопуляции антител с поливалентным антигеном. Рассматриваемый ниже случай может реализоваться, например, при связывании Fab-фрагментов моноклональных антител с клетками, вирусными частицами и т. д., имеющими на своей поверхности большое число одинаковых центров связывания. Выражение для константы равновесия взаимодействия антитела, имеющего по з эпитопов, записывается следующим образом:
![]()
Уравнение Скэтчарда в этом случае принимает вид
![]()
Варьируя концентрацию антител в системе при постоянной концентрации о, можно определить константу комплексообразования К и число мест связывания 6 антигене п.
Так как молекулы антител обладают, по крайней мере, двумя центрами связывания, то при взаимодействии с поливалентным антигеном возможно образование так называемых комплексных связей, когда после взаимодействия одного активного центра молекулы антитела с одним из эпитопов второй активный центр взаимодействует с расположенным поблизости вторым эпитопом той же молекулы антигена. Общая эффективность взаимодействия в этом случае существенно возрастает; в частности, эффективная константа комплексообразования для молекулы IgG может в 103 раз и более превышать Ко одиночных связей. Частота образования таких связей зависит от концентрации реагентов и может колебаться от нуля до максимальной, соответствующей общему количеству молекул IgG в Системе.
Взаимодействие двух субпопуляций антител с моновалентным антигеном. Одним из простых приближений при описании реальных систем взаимодействия моновалентного антигена с антителами может быть модель, согласно которой набор популяций антител заменяется двумя — высокоаффинной и низкоаффинной, каждая из которых характеризуется собственной константой комплексообразования — Кй и Кг. Задача определения констант и концентраций каждой из фракций антител перед экспериментаторами возникает часто. Знание численных значений этих параметров весьма важно для разработки конкретных наборов для иммуноферментного анализа и выбора схемы проведения иммуноанализа с целью достижения требуемой чувствительности определения антигена и специфичности анализа.
