Белки- история исследования, химсостав, свойства, биологические функции
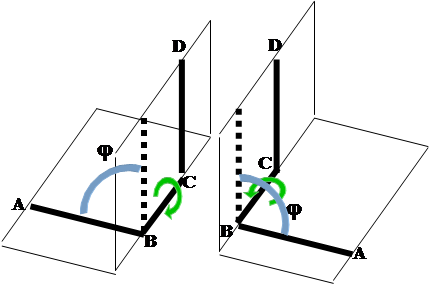
В такой системе возможен случай, когда связи А-В и С-D расположены параллельно и находятся по одну сторону от связи В-С. Если рассматривать эту систему вдоль связи В-С, то связь А-В как бы заслоняет связь C-D, поэтому такая конформация называется заслоненной. Согласно рекомендациям международных союзов химии IUPAC (International Union of Pure and Applied Chemistry) и IUB (International Union of Biochemistry), угол между плоскостями ABC и BCD считается положительным, если для приведения конформации в заслоненное состояние путем поворота на угол не выше 180° ближнюю к наблюдателю связь нужно поворачивать по часовой стрелке. Если эту связь для получения заслоненной конформации нужно поворачивать против часовой стрелки, то угол считается отрицательным. Можно заметить, что это определение не зависит от того, какая из связей находится ближе к наблюдателю.
При этом, как видно из рисунка, ориентация фрагмента, содержащего атомы Ci-1a и Cia [(i-1)-й фрагмент], и фрагмента, содержащего атомы Cia и Ci+1a (i-й фрагмент), определяется торсионными углами, соответствующими вращению вокруг связи Ni¾Cia и связи Cia¾Cik. Эти углы принято обозначать как j и y, в приведенном случае соответственно ji и yi. Их значениями для всех мономерных звеньев полипептидной цепи в основном определяется геометрия этой цепи. Никаких однозначных величин ни для значения каждого из этих углов, ни для их комбинаций не существует, хотя на те и на другие накладываются ограничения, определяемые как свойствами самих пептидных фрагментов, так и природой боковых радикалов, т.е. природой аминокислотных остатков.
К настоящему времени установлены последовательности аминокислот для нескольких тысяч различных белков. Запись структуры белков в виде развернутых структурных формул громоздка и не наглядна. Поэтому используется сокращенная форма записи – трехбуквенная или однобуквенная (молекула вазопрессина):
![]()
![]()
![]() Cys – Tyr – Phe – Gln – Asn – Cys – Pro – Arg – Gly – NH2 CYFQNCPRG – NH2
Cys – Tyr – Phe – Gln – Asn – Cys – Pro – Arg – Gly – NH2 CYFQNCPRG – NH2
![]()
![]()
![]()
![]() S S
S S
При записи аминокислотной последовательности в полипептидных или олигопептидных цепях с помощью сокращенной символики предполагается, если это особо не оговорено, что a-аминогруппа находится слева, а a-карбоксильная группа – справа. Соответствующие участки полипептидной цепи называют N-концом (аминным концом) и С-концом (карбоксильным концом), а аминокислотные остатки – соответственно N-концевым и С-концевым остатками.
4.2. Вторичная структура.
Фрагменты пространственной структуры биополимер, имеющие периодическое строение полимерного остова, рассматривают как элементы вторичной структуры.
Если на протяжении некоторого участка цепи однотипные углы, о которых говорилось на стр.15, приблизительно одинаковы, то структура полипептидной цепи приобретает периодический характер. Существует два класса таких структур – спиральные и растянутые (плоские или складчатые).
Спиральной считается структура, у которой все однотипные атомы лежат на одной винтовой линии. При этом спираль считается правой, если при наблюдении вдоль оси спирали она удаляется от наблюдателя по часовой стрелке, и левой – если удаляется против часовой стрелки. Полипептидная цепь имеет спиральную конформацию, если все атомы Ca находятся на одной винтовой линии, все карбонильные атомы Ck - на другой, все атомы N – на третьей, причем шаг спирали для всех трех групп атомов должен быть одинаков. Одинаковым должно быть и число атомов, приходящихся на один виток спирали, независимо от того, идет ли речь об атомах Ck, Ca или N. Расстояние же до общей винтовой линии для каждого из этих трех типов атомов свое.
Главными элементами вторичной структуры белков являются a-спирали и b-складки.
Спиральные структуры белка. Для полипептидных цепей известно несколько различных типов спиралей. Среди них наиболее распространена правая a-спираль. Идеальная a-спираль имеет шаг 0,54 нм и число однотипных атомов на один виток спирали 3,6, что означает полную периодичность на пяти витках спирали через каждые 18 аминокислотных остатков. Значения торсионных углов для идеальной a-спирали j = – 57° y = – 47 ° , а расстояния от атомов, образующих полипептидную цепь, до оси спирали составляет для N 0,15 нм, для C a 0,23 нм, для C k 0,17 нм. Любая конформация существует при условии, что имеются факторы, стабилизирующие ее. В случае a-спирали такими факторами являются водородные связи, образуемые каждым карбонильным атомом (i+4)-го фрагмента. Важным фактором стабилизации a-спирали также является параллельная ориентация дипольных моментов пептидных связей.
Складчатые структуры белка. Одним из распространенных примеров складчатой периодической структуры белка являются т.н. b-складки, состоящие из двух фрагментов, каждый из которых представлен полипептидом.
b-складки также стабилизируются водородными связями между атомом водорода аминной группы одного фрагмента и атомом кислорода карбоксильной группы другого фрагмента. При этом фрагменты могут иметь как параллельную, так и антипараллельную ориентацию относительно друг друга.
Структура, образующаяся в результате таких взаимодействий, представляет собой гофрированную структуру. Это сказывается на значениях торсионных углов j и y. Если в плоской, полностью растянутой структуре они должны были бы составить 180°, то в реальных b-слоях они имеют значения j = – 119° и y = + 113°. Для того чтобы два участка полипептидной цепи располагались в ориентации, благоприятствующей образованию b-складок, между ними должен существовать участок, имеющий структуру, резко отличающийся от периодической.
4.2.1. Факторы, влияющие на образование вторичной структуры.
Структура определенного участка полипептидной цепи существенно зависит от структуры молекулы в целом. Факторы, влияющие на формирование участков с определенной вторичной структурой, весьма многообразны и далеко не во всех случаях полностью выявлены. Известно, что ряд аминокислотных остатков предпочтительно встречается в a-спиральных фрагментах, ряд других – в b-складках, некоторые аминокислоты – преимущественно в участках, лишенных периодической структуры. Вторичная структура в значительной степени определяется первичной структурой. В некоторых случаях физический смысл такой зависимости может быть понят из стереохимического анализа пространственной структуры. Например, как видно из рисунка в a-спирали сближены не только боковые радикалы соседних вдоль цепи аминокислотных остатков, но и некоторые пары остатков, находящихся на соседних витках спирали, в первую очередь каждый (i+1)-й остаток с (i+4)-м и с (i+5)-м. Поэтому в положениях (i+1) и (i+2), (i+1) и (i+4), (i+1) и (i+5) a-спиралей редко одновременно встречается два объемных радикала, таких, например, как боковые радикалы тирозина, триптофана, изолейцина. Еще менее совместимо со структурой спирали одновременное наличие трех объемных остатков в положениях (i+1), (i+2) и (i+5) или (i+1), (i+4) и (i+5). Поэтому такие комбинации аминокислот в a-спиральных фрагментах являются редким исключением.
