Белки- история исследования, химсостав, свойства, биологические функции
Обратимое осаждение белков (высаливание) предполагает выпадение белка в осадок под действием определенных веществ, после удаления которых он вновь возвращается в свое исходное (нативное) состояние. Для высаливания белков используют соли щелочных и щелочноземельных металлов (наиболее часто в практике используют сульфат натрия и аммония). Эти соли удаляют водную оболочку (вызывают обезвоживание) и снимают заряд. Между величиной водной оболочки белковых молекул и концентрацией солей существует прямая зависимость: чем меньше гидратная оболочка, тем меньше требуется солей. Так, глобулины, имеющие крупные и тяжелые молекулы и небольшую водную оболочку, выпадают в осадок при неполном насыщении раствора солями, а альбумины как более мелкие молекулы, окруженные большой водной оболочкой, – при полном насыщении.
|
|
 |  | ||
в кровь.
Размер белковых молекул лежит в пределах 1 мкм до 1 нм и, следовательно, они являются коллоидными частицами, которые в воде образуют коллоидные растворы. Эти растворы характеризуются высокой вязкостью, способностью рассеивать лучи видимого света, не проходят сквозь полупроницаемые мембраны.
Вязкость раствора зависит от молекулярной массы и концентрации растворенного вещества. Чем выше молекулярная масса, тем раствор более вязкий. Белки как высокомолекулярные соединения образуют вязкие растворы. Например, раствор яичного белка в воде.
![]()
|
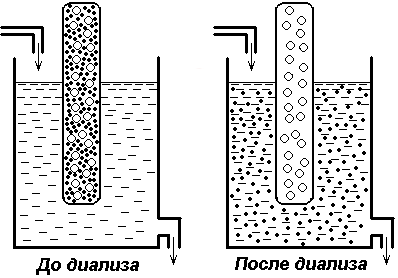 |
Диализ (белые крупные кружки – молекулы белка, черные – молекулы хлористого натрия)
Глава 6. Классификация белков
Все белки в зависимости от строения делятся на простые – протеины, состоящие только из аминокислот, и сложные - протеиды, имеющих небелковую протеистическую группу.
6.1. Протеины
Протеины представляют собой простые белки, состоящие только из белковой части. Они широко распространены в животном и растительном мире. К ним относятся альбумины и глобулины, встречающиеся практически во всех животных и растительных клетках, биологических жидкостях и выполняющих важные биологические функции. Альбумины участвуют в поддержании осмотического давления крови (создают онкотическое давление), транспортируют с кровью различные вещества. Глобулины входят в состав ферментов, составляющих основу иммуноглобулинов, выполняющих функции антител. В сыворотке крови между этими двумя компонентами существует постоянное соотношение – альбумино-глобулиновый коэффициент (А/Г), равный 1,7 – 2,3 и имеющий важное диагностическое значение.
Другими представителями протеинов являются протамины и гистоны – белки основного характера, содержащие много лизина и аргинина. Эти белки входят в состав нуклеопротеидов. Другой основной белок – коллаген – образует внеклеточное вещество соединительной ткани и находится в коже, хрящах и др. тканях.
6.2. Протеиды
Протеиды являются сложными белками, состоящими из белковой и небелковой частей. Название протеида определяется названием его простетической группы). Так, нуклеиновые кислоты являются небелковой частью нуклеопротеидов, фосфорная к-та входит в состав фосфопротеидов, углеводы – гликопротеидов, а липиды – липопротеидов.
Нуклеопротеиды. Имеют важное значение, т.к. их небелковая часть представлена ДНК и РНК. Простетическая группа представлена в основном гистонами и протаминами. Такие комплексы ДНК с гистонами обнаружены в сперматозоидах, а с гистонами – в соматических клетках, где молекула ДНК “намотана” вокруг молекул гистонов. Нуклепротеидами по своей природе являются вне клетки вирусы – это комплексы вирусной нуклеиновой к-ты и белковой оболочки – капсида.
Хромопротеиды. Являются сложными белками, простетическая группа которых представлена окрашенными соединениями. К хромопротеидам относятся гемоглобин, миоглобин (бело мышц), ряд ферментов (каталаза, пероксидаза, цитохромы), а также хлорофилл.
Гемоглобин (Hb) состоит из белка глобина и небелковой части гема, включающего атом Fe(II), соединенный с протопорфирином. Молекула гемоглобина состоит из 4-х субъединиц: двух a и двух b и соответственно содержит четыре полипептидные цепочки двух сортов. Каждая a-цепочка содержит 141, а b-цепочка – 146 аминокислотных остатков.
