Биосинтез 2Н-меченого инозина высокого уровня дейтерированности
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для синтеза 2Н-меченого инозина использовали мутантный штамм грамположительных бактерий Bacillus subtilis (предварительно адаптированный к дейтерию скринингом до отдельных колоний), который из-за нарушения метаболических путей регуляции биосинтеза пуриновых рибонуклеозидов синтезирует в стандартных условиях выращивания (дрожжевая среда, поздний экспоненциальный рост, 32-340С) 17 г инозина на 1 л культуральной жидкости (КЖ) [32]. Максимальный выход инозина достигался при использовании природной протонированной среды, содержащей в качестве в качестве источников ростовых факторов и аминного азота 2% БВК дрожжей, а в качестве источника углерода и энергии глюкозу (не менее 12 мас.%). При проведении синтеза требовалось заменить протонированные ростовые субстраты их дейтерированными аналогами, а также использовать 2Н2О высокого уровня изотопной чистоты. Для решения поставленной задачи использовали адаптированный к дейтерию штамм факультативных метилотрофных бактерий Brevibacterium methylicum с 50% уровнем биоконверсии метанола (при эффективности конверсии 15.5-17.3 г сух. биомассы на 1 г потребленного субстрата) [33]. Проведение адаптации для B. methylicum определялось необходимостью улучшить ростовые характеристики штамма в максимально дейтерированной среде, поэтому использовали ступенчато-увеличивающийся градиент концентрации 2Н2О в ростовых средах в присутствии 2% метанола (табл. 1). Для изучения влияния уровня дейтерированности источника углерода на ростовые параметры штамма в опытах (1, 3, 5, 7 и 9) использовали протонированный метанол, а в опытах (2, 4, 6, 8 и 10) [U-2Н]метанол. Согласно полученным данным замена протонированного метанола его дейтерированным аналогом в условиях одинаковой концентрации 2Н2О в среде приводила к небольшим уменьшениям ростовых характеристик штамма (табл. 1, опыты 2, 4, 6, 8 и 10). Поэтому в дальнейших опытах использовали среды с 2Н2О и [U-2Н]метанолом. На контрольной протонированной среде (1) с водой и метанолом продолжительность лаг-периода и времени клеточной генерации B. methylicum составили 20 и 2.2 ч, а выход микробной биомассы 200 г с 1 л КЖ (табл. 1, опыт 1). В промежуточных опытах (2-10) биосинтетические параметры изменялись пропорционально концентрации 2Н2О. Найденная закономерность заключалась в увеличении продолжительности лаг-периода и времени клеточной генерации при уменьшении выходов микробной биомассы с фиксированием самых низких значений этих параметров в максимально дейтерированной среде с 98% 2Н2О и 2% [U-2H]метанолом (табл. 1, опыт 10). За ходом адаптации, условия которой показаны в опыте 10’ (табл. 1) наблюдали, снимая динамики роста исходного (б) и адаптированного к дейтерию (в) штамма в максимально дейтерированной среде М9 (рис. 1, контроль (а) получен в протонированной среде), а также по изменению продолжительности лаг-периода, времени генерации и выходов микробной биомассы (рис. 2). В отличие от адаптированного штамма (в), ростовые динамики исходного штамма (б) в максимальной дейтерированной среде ингибировались дейтерием (рис. 1).
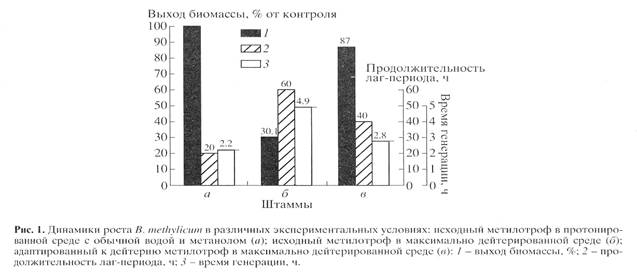
Выход микробной биомассы у адаптированного штамма (в) уменьшался на 13% по сравнению с контрольными условиями (рис. 2, а) при увеличении времени генерации до 2.8, а продолжительности лаг-периода до 40 ч (рис. 2, в). Адаптированный штамм возвращался к нормальному росту при переносе в протонированную среду после пролонгированного лаг-периода, что доказывает фенотипическую природу феномена адаптации, хотя теоретически не исключается, что эффект реверсии стабильно сохраняется при росте в 2Н2О, но маскируется при переносе клеток в протонированную среду. Улучшенные ростовые характеристики адаптированного метилотрофа существено упрощают схему синтеза 2Н-меченой биомассы, оптимальным условиям которой удовлетворяет максимально дейтерированная среда М9 с 98% 2Н2О и 2% [U-2Н]метанолом с инкубационным периодом 5-6 сут при 370С.
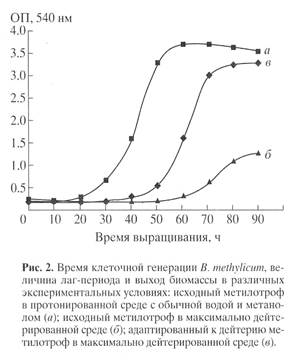
Схема синтеза 2Н-меченого инозина разрабатывалась с учетом способности метилотрофных бактерий синтезировать большое количество белка (выход 50% от веса сухого вещества), 15-17% полисахаридов, 10-12% липидов (в основном, фосфолипиды) и 18% зольных веществ [34]. Гидролиз биомассы проводили автоклавированием в 0.5 н. 2НCl (в 2Н2O), чтобы обеспечить высокие выходы этих соединений и минимизировать реакции обратного (1Н-2Н) обмена в аминокислотных остатках молекул белков. Качественный и количественный состав ароматических аминокислот метилотрофного гидролизата изучали в дейтерированной среде М9 на катионообменной колонке Biotronic LC-5001 (ФРГ) с сульфированной смолой UR-30, а уровни дейтерированности молекул масс-спектрометрией электронного удара метиловых эфиров N-диметиламинонафталин-5-сульфонильных производных аминокислот. Гидролизат представлен пятнадцатью идентифицированными аминокислотами (за исключением пролина, который детектировался при 440 нм) при выходах аминокислот, сопоставимом с потребностями штамма в источниках углерода и аминного азота (табл. 2). При этом индикатором, определяющим высокую эффективность включения дейтерия в синтезируемый продукт служит высокий уровень дейтерированности молекул аминокислот, который варьирует от 49% для лейцина/изолейцина до 97.5% для аланина (табл. 2).
Биосинтетические характеристики штамма B. subtilis снимали в протонированной дрожжевой среде с обычной водой и синтетической тяжеловодородной среде с 2Н2О и 2% 2Н-меченым метилотрофным гидролизатом B. methylicum (рис. 3). Отмечена корреляция в характере изменения ростовых динамик (рис. 3, 1а, 2а), выхода инозина (рис. 3, 1б, 2б) и ассимиляции глюкозы (рис. 3, 1в, 2в). Максимальный выход инозина (17 г/л) зафиксирован в опыте 1б (рис. 3, 1б) на протонированной среде при уровне ассимилируемой глюкозы 10 г/л (рис. 3, 1в). На тяжеловодородной среде выход инозина снижался в 4.4 (3.9 г/л) (рис. 3, 2б), а уровень ассимиляции глюкозы в 4 раза, о чем свидетельствует 40 г/л неассимилируемой глюкозы в КЖ (рис. 3, 2в).
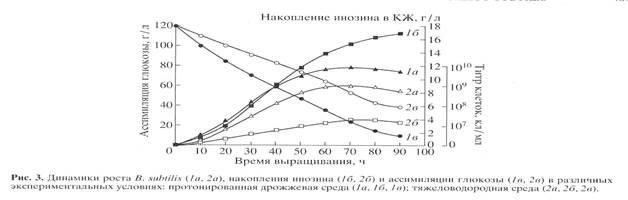
Таблица 2. Аминокислотный состав метилотрофного гидролизата и уровни дейтерированности молекул
|
Аминокислота |
Выход, % от сухого веса 1 г биомассы |
Величина молекулярного иона Мr |
Количество включенных атомов дейтерия в углеродный скелет молекулы |
Уровень дейтерированности молекул, % от общего количества атомов водорода | |
|
Глицин |
9.69 |
324 |
2 |
90.0 | |
|
Аланин |
13.98 |
340 |
4 |
97.5 | |
|
Валин |
3.74 |
369 |
4 |
50.0 | |
|
Лейцин |
7.33 |
383 |
5 |
49.0 | |
|
Изолейцин |
3.64 |
383 |
5 |
49.0 | |
|
Фенилаланин |
3.94 |
420 |
8 |
95.0 | |
|
Тирозин |
1.82 |
669 |
7 |
92.8 | |
|
Серин |
4.90 |
355 |
3 |
86.6 | |
|
Треонин |
5.51 |
не детектировался |
- |
- | |
|
Метионин |
2.25 |
не детектировался |
- |
- | |
|
Аспарагин |
9.59 |
396 |
2 |
66.6 | |
|
Глутаминовая кислота |
10.38 |
411 |
4 |
70.0 | |
|
Лизин |
3.98 |
632 |
5 |
58.9 | |
|
Аргинин |
5.27 |
не детектировался |
- |
- | |
|
Гистидин |
3.72 |
не детектировался |
- |
- |
