Биосинтез 2Н-меченого инозина высокого уровня дейтерированности
Полученный результат требовал изучение содержания глюкозы в биомассе штамма после гидролиза, осуществленное методом обращенно-фазовой ВЭЖХ (табл. 3). Смесь гидролизных сахаров в табл. 3 (нумерация приведена по последовательности их элюции с колонки) составляли моно-(глюкоза, фруктоза, рамноза, арабиноза), ди-сахариды (мальтоза, сахароза), а также четыре других неидентифицированных сахара с временами удерживания 3.08 (15.63%), 4.26 (7.46%), 7.23 (11.72%) и 9.14 (7.95%) мин (не показаны). Выход глюкозы в дейтерированном гидролизате составляет 21.4% от сух. веса, то есть выше, чем фруктозы (6.82%), рамнозы (3.47%), арабинозы (3.69%) и мальтозы (11.62%). Их выхода существенно не отличались от контроля на Н2О, за исключением сахарозы, не детектируемой в дейтерированном гидролизате.
Таблица 3. Состав сахаров гидролизата штамма-продуцента
|
протонированная среда тяжеловодородная среда | ||
|
Глюкоза |
20.01 |
21.4 |
|
Фруктоза |
6.12 |
6.82 |
|
Рамноза |
2.91 |
3.47 |
|
Арабиноза |
3.26 |
3.69 |
|
Мальтоза |
15.3 |
11.62 |
|
Сахароза |
8.62 |
- |
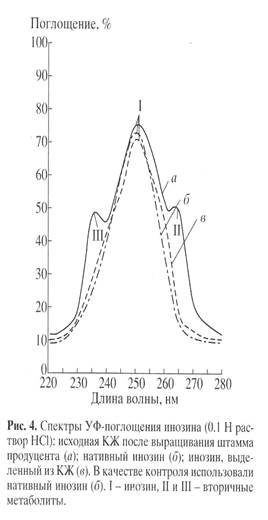
Применение сложных физико-химических методов для выделения биосинтетически 2Н-меченого инозина из КЖ диктовалось необходимостью получать инозин высокой степени хроматографической чистоты. Поскольку в КЖ наряду с синтезируемым продуктом присутствуют примеси неорганических солей, белков и полисахаридов, а также сопутствующие вторичные метаболиты нуклеиновой природы (аденозин, гуанозин) и непрореагировавшие субстраты (глюкоза, аминокислоты), проводили ступенчатое фракционирование КЖ. Повышенная чувствительность инозина к кислотам и щелочам и его нестабильность при выделении диктовали использование кислотных и щелочных растворов низкой концентрации, а также по-возможности проводить выделение при низких температурах, избегая длительного перегрева реакционной смеси. Фракционирование КЖ заключалось в низкотемпературном осаждении высокомолекулярных примесей органическими растворителями ацетоном и метанолом, твердофазной адсорбции/десорбции на поверхности активированного угля, экстрактивного извлечения продукта, перекристаллизации и ионообменной хроматографии. Белки и полисахариды удаляли низкотемператрным осаждением ацетоном при -40С, проводя последующую адсорбцию суммы рибонуклеозидов активированным углем на холоду. Десорбированные рибонуклеозиды извлекали из прореагировавшей твердой фазы элюцией этанольно-аммиачным раствором при 600С, а сам инозин экстракцией 0.3 М NH4-формиатным буфером (рН 8.9) с последующей перекристаллизацией в 80% этаноле. Окончательная стадия очистки заключалась в колоночной ионообменной хроматографии на катионообменнике AG50WX 4, уравновешенным 0.3 М NH4-формиатным буфером с 0.045 М NH4Cl с ТСХ контролем при Rf 0.5. Данные по выделению инозина из КЖ штамма-продуцента представлены в виде спектров УФ-поглощения на рис. 4, а-в. Наличие в синтетическом образце (в) основной полосы поглощения I, соответствующей нативному инозину (lmax 249 нм, e249 7100 М-1 см-1) и отсутствие вторичных метаболитов II и III неоспоримо доказывает его однородность и тем самым эффективность разработанного метода выделения со степенью хроматографической чистоты 92%.
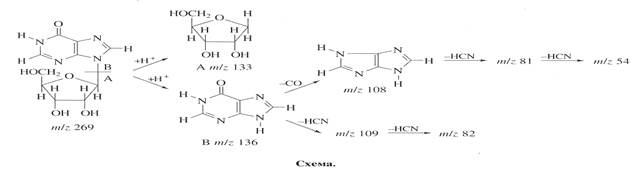
Уровень дейтерированности инозина исследовали методом масс-спектрометрии FAB из за высокой чувствительности, позволяющей детектировать 10-8-10-10 моль вещества в пробе, что существенно выше чем при использовании 1Н ЯМР-спектроскопии [7]. Пути фрагментации молекулы методом FAB приводят к распаду инозина на фрагмент рибозы А с Мr при массовом соотношении m/z 133 и гипоксантиновый фрагмент Б c Мr m/z 136 (их распад сопровождался миграцией протона Н+), который в свою очередь расщепляется на ряд менее низкомолекулярных осколочных фрагментов В, Г, Д, Е и Ж при m/z 109, 108, 82, 81 и 54 за счет элиминирования НСN и СО из гипоксантина (схема).
Биосинтетический 2Н-меченый инозин (масс-спектр приведен на рис. 5, б относительно контроля (а)), представлен смесью изотопнозамещенных форм молекул с различным количеством атомов водорода, замещенных на дейтерий. Подсчет уровня дейтерированности молекулы инозина определяли, сравнивая величины пиков молекулярных ионов Мr инозина дейтерированного и протонированного образцов (формирование пика молекулярного иона инозина сопровождалось миграцией протона Н+). Пик (М+Н)+ полиморфно расщеплялся на отдельные кластеры с примесью молекул со статистическим набором массовых чисел m/z с различным вкладом в суммарный уровень дейтерированности с включением четырех (m/z 273, 20%), пяти (m/z 274, 38%), шести (m/z 275, 28%) и семи атомов дейтерия (m/z 276, 14%) (табл. 4).

Суммарный уровень дейтерированности молекулы (УД), вычесленный по приводимой ниже формуле составил 61% от общего количества атомов водорода в углеродном скелете молекулы.
Mr1 C1 + Mr2 C2 + . + Mrn Cn
УД =
S Cn
(Mr - величины пиков молекулярных ионов инозина; Сn - вклад в уровень дейтерированности, мол.%).
Анализ масс-спектра FAB выявил включение атомов дейтерия в рибозный и гипоксантиновый фрагменты молекулы, что подтверждено присутствием двух “тяжелых” пиков фрагментов рибозы А m/z 136, 46% (вместо m/z 133, 41%) и гипоксантина Б m/z 138, 55% (вместо m/z 136, 48%), а также пиков низкомолекулярных фрагментов, продуктов распада гипоксантина В m/z 111, 49% (вместо m/z 109, 45%) и Г m/z 84, 43% (вместо m/z 82, 41%) (рис. 5).
Таблица 4. Величины пиков (М+Н)+ в масс-спектрах FAB и уровни дейтерированности инозина
|
Величина пика (М+Н)+ |
Вклад в уровень дейтерированности, мол.% |
Количество атомов дейтерия |
Уровень дейтерированности, % от общего количества атомов водорода |
|
273 |
20 |
4 |
20.0 |
|
274 |
38 |
5 |
62.5 |
|
275 |
28 |
6 |
72.5 |
|
276 |
14 |
7 |
87.5 |
