Биосинтез дезоксирибонуклеотидов
СОДЕРЖАНИЕ:
Введение
1. Биосинтез пуриновых нуклеотидов
2. Образование AMP и GMP из IMP
3. Ингибиторы биосинтеза пуринов
4. Синтез пуриновых дезоксирибонуклеотидов
5. Тканевая специфичность биосинтеза пуринов
6. Регуляция биосинтеза пуринов
7. Биосинтез пиримидинов
8. Регуляция биосинтеза пиримидинов
9. Ингибиторы ферментов синтеза дезоксирибонуклеотидов и их использование для лечения злокачественных новообразований
10. Список литературы
ВВЕДЕНИЕ
Ни сами нуклеотиды, ни исходные пуриновые и пиримидиновые основания, поступающие в организм человека с пищей, не включаются ни в нуклеиновые кислоты тканей человека, ни в пуриновые или пиримидиновые коферменты, такие, как АТР или NAD. Даже если пища богата нуклеопротеинами, клетки человека все равно синтезируют предшественники нуклеиновых кислот из амфиболических промежуточных соединений (интермедиатов). Путь синтеза de novo позволяет синтетическим аналогам пуринов и пиримидинов с антиканцерогенными свойствами включаться в состав ДНК.
Скорость синтеза пуриновых и пиримидиновых рибо- и дезоксирибонуклеотидов является объектом тонкой регуляции. Сформировались механизмы, обеспечивающие такой уровень продукции этих соединений во времени, который удовлетворяет постоянно меняющиеся физиологические потребности организма. Наряду с синтезом de novo включаются так называемые пути «спасения», благодаря которым происходит реутилизация пуриновых и пиримидиновых оснований высвобождаемых из нуклеиновых кислот при деградации in vivo. К заболеваниям, которые связаны с нарушениями обмена пуринов и пиримидинов, относятся подагра, синдром Леша— Найхана, синдром Рейе, недостаточность аденозин-дезаминазы, недостаточность пуриннуклеозидфосфорилазы.
1. Биосинтез пуриновых нуклеотидов
У человека и других млекопитающих пуриновые нуклеотиды синтезируются для обеспечения потребностей организма в мономерных предшественниках нуклеиновых кислот, а также в соединениях, выполняющих другие функции. У некоторых позвоночных (птицы, земноводные, рептилии) синтез пуриновых нуклеотидов несет дополнительную функцию — является частью механизма, с помощью которого выводятся излишки азота в виде мочевой кислоты; такие организмы называют урикотелическими. Организмы, у которых конечным продуктом азотистого обмена является мочевина (как у человека), называют уреотелическими. Поскольку урикотелические организмы удаляют «излишки» азота в виде мочевой кислоты, синтез пуриновых нуклеотидов у них идет более интенсивно, чем у уреотелических. В то же время пути синтеза пуриновых нуклеотидов de novo — общие для обеих групп организмов.
Информация о происхождении каждого из атомов в молекуле пуринового основания получена в процессе радиоизотопных исследований, проведенных на птицах, крысах и человеке (рис. 1). На рис. 2 представлена схема пути биосинтеза пуриновых нуклеотидов. Первая стадия {реакция 1)— образование 5-фосфорибозил-1-пирофосфата (ФРПФ). Эта реакция не уникальна для биосинтеза пуриновых нуклеотидов. ФРПФ служит также предшественником в синтезе пиримидиновых нуклеотидов (см. рис. 10), он необходим для синтеза NAD и NADP—двух коферментов, в состав которых входит никотиновая кислота. В реакции 2 (рис. 2), катализируемой фосфорибозил-пирофосфат-амидотрансферазой, из ФРПФ и глутамина образуются глутамат и 5-фосфорибозиламин. Хотя возможны и другие механизмы синтеза 5-фосфорибозиламина, реакция, катализируемая амидотрансферазой, имеет наиболее важное физиологическое значение в тканях млекопитающих.
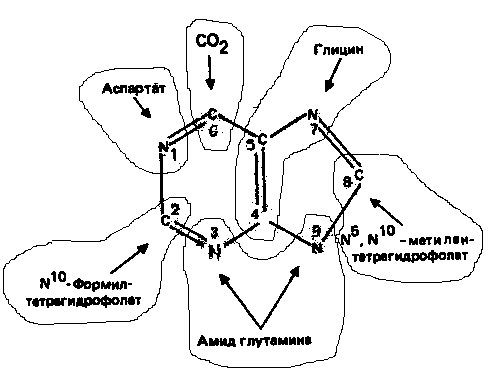
Рисунок 1. Происхождение атомов азота и углерода пуринового кольца.
Далее 5-фосфорибозйламин вступает в реакцию с глицином (реакция 3); при этом образуется глицинами д-рибозилфосфат (глицинамидориботид, Г АР). Амидная группа глутамина служит источником атома азота в положении 9 молекулы пурина (N-9), а глицин—источником атомов углерода в положениях 4 и 5 (С-4 и С-5) пуринового кольца. Эту реакцию катализирует глицинамид-киносинтетаза. Вреакции 4 атом азота N7 молекулы глицинамид-рибозилфосфата формилируется N5, N10-Me-тенилтетрагидрофолатом. В результате этой реакции, катализируемой глицинамид-рибозил-фосфат-формилтрансферазой, поступающий одно-углеродный фрагмент займет положение С-8 в формирующемся пуриновом основании. В реакции 5 снова участвует глутамин — донор амидной группы. Амидирование происходит по атому С-4 формилглицинамид-рибозилфосфата и катализируется формилглицин-амидин-рибозилфосфатсинтетазой.Присоединенный атом азота займет в молекуле пурина положение 3.
В результате замыкания имидазольного кольца, катализируемого аминоимидазолрибозилфос-фатсинтетазой,образуется аминоимидазол-рибозилфосфат (реакция 6). Далее синтез проходит через стадию образования аминоимидазолкар-боксилат-рибозилфосфата (реакция 7). В результате реакции формируется карбонильная группа, источником которой служит молекула СО2, образующаяся в процессе дыхания.
Атом азота в положении 1 происходит из а-аминогруппы аспартата (реакция 8), остальная часть которого образует сукцинильный фрагмент в молекуле аминоимидазолсукцинилкарбоксиламид-рибо-зилфосфата (АИСКАР).
В реакции 9 сукцинильная группа АИСКАР удаляется в виде фумарата. Оставшийся аминоимида-золкарбоксиламид-рибозилфосфат формилируется (реакция 10) N 10-формилтетрагидрофолатом (f10-Н4фолат) с образованием амидоимидазолкарбокси-ламид-рибозилфосфата; реакция катализируется соответствующей формилтрансферазой. Вновь присоединенный атом углерода, подобно атому С-8, поступает из пула одноуглеродных фрагментов при участии тетрагидрофолата и занимает в молекуле пурина положение 2.
Замыкание кольца (реакция 11) происходит с помощью IMP-циклогидролазы, в результате образуется первый пуриновый нуклеотид—инозиновая кислота (инозинмонофосфат; IMP).
Значение метаболизма фолатов
В процессе биосинтеза пуриновых нуклеотидов (рис. 2) атомы углерода в положениях 8 и 2 поступают соответственно от N5, М10-метенилтет-рагидрофолата и N10-формилтетрагидрофолата. Последний образуется из N5, N10-метенилтетрагидрофолата, который в свою очередь является продуктом NADP-зависимого дегидрогенирования N5, N10-метилентетрагидрофолата. Если N5, N10-метилентетрагидрофолат служит источником одноуглеродных фрагментов для многих акцепторов, то N5,
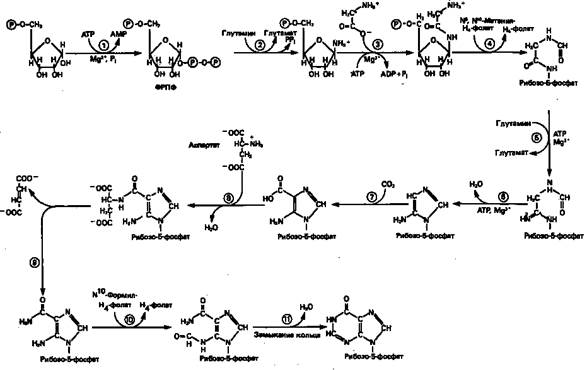
Рисунок 2. Путь биосинтеза de novo пуринов из рибозо-5-фосфата и АТР
N10-метенилтетрагидрофолат поставляет одноуглеродную группу (либо непосредственно, либо через стадию образования N10-формилтетра-гидрофолата) только в пурины. Из приведенных сведений следует, что ингибирование процессов образования рассмотренных фолатов оказывает тормозящее влияние и на синтез пуринов de novo.
2. Образование AMP и GMP из IMP
Как показано на рис. 3 адениновые (реакции 12 и 13) и гуаниновые нуклеотиды (реакции 14 и 15) образуются путем аминирования и соответственно окисления и аминирования общего предшественника—инозинмонофосфата (IMP). Аминирование IMP протекает через стадию образования промежуточного соединения, в котором аспартат присоединяется к инозиновой кислоте, образуя аденилосукцинат. Эта реакция напоминает реакцию 8 биосинтеза пуринов (рис. 2), в которой а-азот аспарагиновой кислоты поставляет атом N-1 пуринового кольца. Образование аденилосукцината катализируется аденилосукцинатсинтазой и происходит при участии GTP. Удаление остающейся части аспарагиновой кислоты в виде фумарата приводит к образованию адениловой кислоты (аденозинмонофосфат; AMP). Отщепление фумарата от аденилосукцината катализируется ферментом аденилосукциназой. Этот же фермент катализирует отщепление фумарата от аминоимидазолсукцинилкарбоксамидрибозил-фосфата (реакция 9).
