Биосинтез дезоксирибонуклеотидов
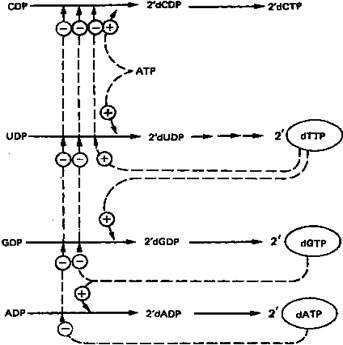
Рисунок 8. Регуляция восстановления пуриновых и пиримидиновых рибонуклеотидов до соответствующих 2'-дезоксирибонуклеотидов. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную и отрицательную регуляцию по принципу обратной связи.
7. Биосинтез пиримидинов
Структура ядра пиримидинов проще и путь их биосинтеза короче, чем у пуринов. В то же время оба пути имеют ряд общих предшественников. ФРПФ, глутамин, СО2 и аспартат необходимы для синтеза всех пиримидиновых и пуриновых нуклеотидов. Синтез тимидиновых нуклеотидов, а также всех пуриновых нуждается в присутствии производных тетрагидрофолата. Можно отметить одно существенное различие в путях биосинтеза пуриновых и пиримидиновых нуклеотидов. В первом случае синтез начинается с молекулы рибозофосфата как интегральной части будущей молекулы предшественника нуклеотида, во втором случае сначала синтезируется пиримидиновое основание и только на последних стадиях присоединяется остаток рибозофосфата.
Синтез пиримидинового кольца (рис. 9) начинается с образования карбамоилфосфата из глутамина, АТР и СО2 в реакции, катализируемой в цитозоле карбамоилфосфатсинтазой (реакция 1). Отметим, что карбамоилфосфатсинтаза, ответственная за ранние стадии синтеза мочевины, локализована в митохондриях.
Первый уникальный для биосинтеза пиримидинов этап — образование карбамоиласпартата в реакции конденсации карбамоилфосфата и аспартата катализируется аспартаттранскарбамоилазой (реакция 2). Затем в реакции, катализируемой дигидрооротазой, выщепляется Н2О и образуется кольцевая структура (реакция 3).
На следующем этапе происходит дегидрогенирование под действием дигидрооротатдегидрогеназы с использованием NAD в качестве кофактора, при этом образуется оротовая кислота (реакция 4).
В реакции 5 к оротовой кислоте присоединяется остаток рибозофосфата с образованием оротидилата (оротидинмонофосфат, ОМР). Этот процесс осуществляется оротат-фосфорибозилгрансферазой — ферментом, аналогичным гипоксантин-гуанин—фосфорибозилтрансферазе и аденин-фосфорибозил-трансферазе, которые участвуют в фосфорибозилировании пуриновых колец.
Первый истинный пиримидиновый рибонуклеотид—уридилат (уридинмонофосфат, UMP) образуется при декарбоксилировании оротидилата (реакция 6). Таким образом, только на предпоследней стадии образования UMP происходит фосфорибозилирование гетероцикла.
Дигидрооротатдегидрогеназа митохондриальный фермент. Все остальные ферменты, участвующие в синтезе пиримидинов de novo, локализуются в цитозоле.
Фосфорилирование пиримидиновых нуклеозидмонофосфатов до соответствующих ди- и трифосфатов происходит аналогично тому, как это описано для пуриновых нуклеозидмонофосфатов (реакции 7—12). UTP аминируется до СТР; в реакции участвуют глутамин и АТР (реакция 9). Механизм восстановления пиримидиннуклеозиддифосфатов до соответствующих 2/-дезоксинуклеозиддифосфатов (реакция 10) также аналогичен тому, который описан для пуриновых нуклеозиддифосфатов (рис. 5 и 8).
Образование тимидилата (тимидинмонофосфат; ТМР) (реакция 12) — единственная реакция на пути биосинтеза пиримидиновых нуклеотидов, требующая участия производного тетрагидрофолата в качестве донора одноуглеродного фрагмента. 2'-Дезокси-UMP метилируется тимидилатсинтазой, использующей N5, N10-метилентетрагидрофолат как донор метильной группы.
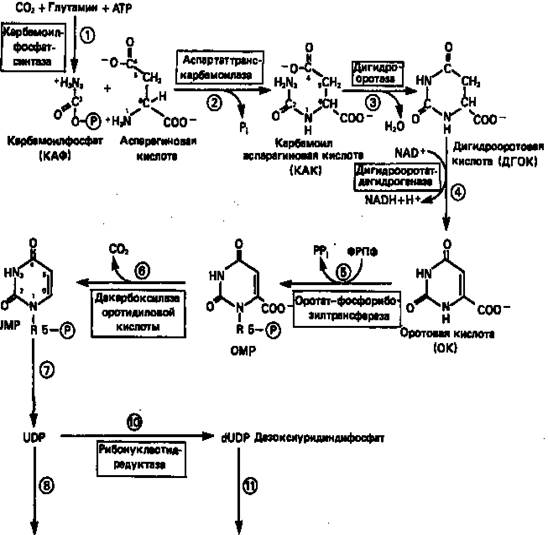
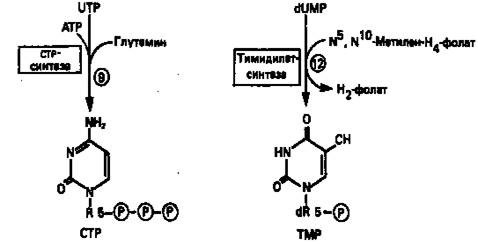
Рисунок 9. Путь биосинтеза пиримидиновых нуклеотидов.
Метиленовая группа N5, N10-метилентетрагидрофолата в ходе реакции восстанавливается до метильной и присоединяется к атому С-5 dUMP. Процесс сопровождается окислением тетрагидрофолатного переносчика до дигидрофолата. Можно считать, что в результате метилирования dUMP с образованием ТМР происходит полное восстановление гидроксиметильной группы серина (переносимой на тетрагидрофолат при образовании N5, N10-метилентетрагидрофолата) до метильной с одновременным окислением тетрагидрофолата до дигидрофолата. Для того чтобы фолатный переносчик и далее мог функционировать, необходимо восстановить дигидрофолат до тетрагидрофолата. Эту реакцию катализирует дигидрофолатредуктаза. Именно поэтому делящиеся клетки, вынужденные синтезировать ТМР с образованием дигидрофолата, оказываются особенно чувствительны к ингибиторам дигидрофолатредуктазы. Один из таких ингибиторов — метотрексат (аметоптерин) широко используется как противоопухолевый препарат (см. ниже).
8. Регуляция биосинтеза пиримидинов
Путь биосинтеза пиримидиновых нуклеотидов регулируется двумя различными механизмами. Активность первых двух ферментов находится под контролем аллостерических эффекторов. Кроме того, три первых и два последних фермента являются объектами координированной репрессии—дерепрессии. Карбамоилфосфатсинтаза ингибируется UTP, пуриновыми нуклеотидами, но активируется ФРПФ (рис. 10). Аспартаттранскарбамоилаза особенно чувствительна к ингибирующему влиянию СТР. Аллостерические свойства аспартаткарбамоилазы микроорганизмов явились предметом интенсивных и ставших уже классическими исследований механизмов аллостерической регуляции активности ферментов.
Скорость биосинтеза пиримидинов коррелирует со скоростью биосинтеза пуринов, что указывает на координированный контроль синтеза нуклеотидов обоих типов. ФРПФ-синтетаза, фермент, катализирующий образование предшественника обоих путей биосинтеза, ингибируется по принципу обратной связи как пуриновыми, так и пиримидиновыми нуклеотидами. Карбамоилфосфатсинтаза также подвержена ингибированию по принципу обратной связи нуклеотидами обоих типов, а ФРПФ активирует этот фермент. Таким образом, на нескольких этапах биосинтеза пуриновых и пиримидиновых нуклеотидов осуществляется перекрестная регуляция.
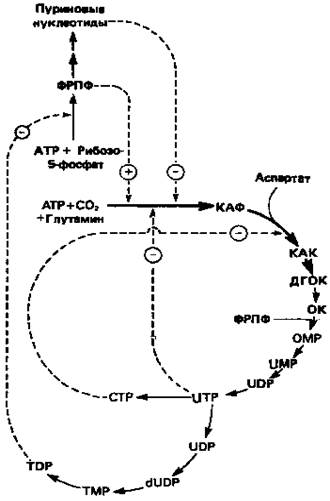
Рисунок 10. Регуляция пути биосинтеза пиримидиновых нуклеотидов. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную и отрицательную регуляцию по принципу обратной связи. Сокращения расшифрованы на рис. 9.
9. ИНГИБИТОРЫ ФЕРМЕНТОВ СИНТЕЗА ДЕЗОКСИРИБОНУКЛЕОТИДОВ И ИСПОЛЬЗОВАНИЕ ИХ ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
Препараты этой группы являются антагонистами естественных метаболитов. При наличии опухолевых заболеваний используют в основном следующие вещества (см. структуры).
Антагонисты фолиевой кислоты: Метотрексат (аметоптерин).
Антагонисты пурина: Меркаптопурин (леупурин, пуринетол).
Антагонисты пиримидина: Фторурацил (флуороурацил); Фторафур (тегафур); Цитарабин (цитозар).
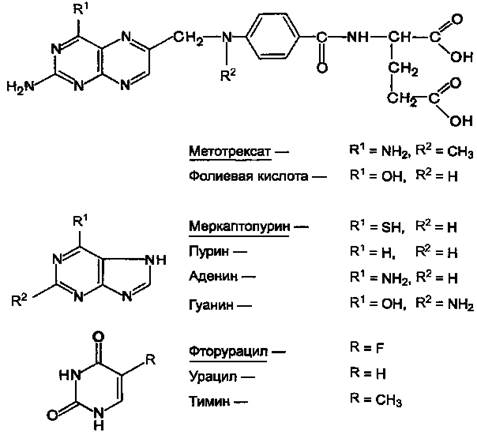
Рисунок 11.Химические структуры ряда метаболитов и их антиметаболитов.
Химически антиметаболиты лишь похожи на естественные метаболиты, но не идентичны им. В связи с этим они вызывают нарушение синтеза нуклеиновых кислот.
