Исследование действия папаина на модифицированный in vivo фазеолин
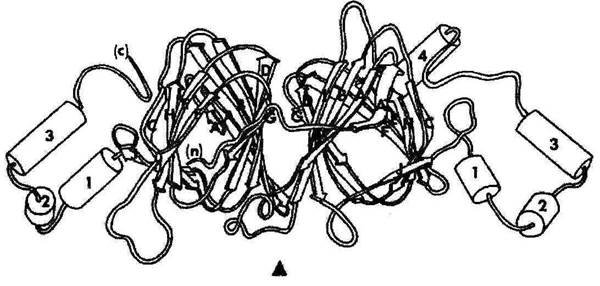
Рис. 1. Третичная структура фазеолина типа β (по Lawrence и др.[13]).
Диаграмма третичной структуры, которая отображает пару структурных групп α и β.
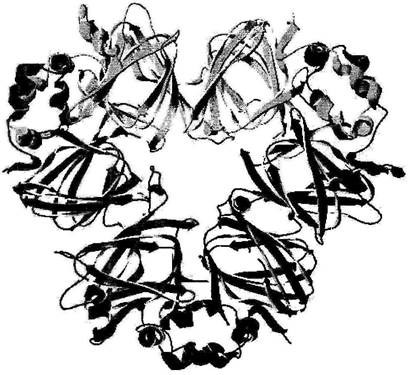
Рис. 2. Четвертичная структура фазеолина (1 PHL). [34].
2.2 Протеолитические ферменты.
2.2.1 Общие сведения о протеолитических ферментах.
Протеолитические ферменты (протеазы, пептид-гидролазы, ферменты класса гидролаз) содержатся во всех живых организмах. Они принимают участие в различных физиологических процессах выполняя важные функции, катализируют гидролиз пептидных связей в клеточных белках и белках пищи поступающей в организм. Протеолитические ферменты разделяются на пептидазы (экзопептидазы) и протеиназы (эндопептидазы). В клетке протеолитические ферменты локализованы в различных компартментах: цитоплазме, вакуолях, лизосомах, митохондриях, эндоплазматическом ретикулуме и других. Пептидазы гидролизуют обычно внешние пептидные связи в белках, а протеиназы – внутренние связи. По строению активного центра протеолитические ферменты разделяют на сериновые, цистеиновые, глютаминовые, аспартильные и металлопротеиназы, которые содержат в активном центре атом металла. Протеиназы делятся также по субстратной специфичности, по способности гидролизовать связи между определенными аминокислотными остатками [35, 37].
В мобилизации запасных белков в прорастающих семенах участвуют преимущественно цистеиновые протеиназы двух типов – Асн-специфичная протеиназа легумаин и папаиноподобные протеиназы, гомологичные папаину и сходные с ним по субстратной специфичности, что позволяет использовать папаин в качестве модельного фермента при исследовании закономерностей протеолиза, который осуществляется эндогенными цистеиновыми протеиназами in vivo и in vitro [38].
2.2.2 Характеристика папаина.
Папаин является одним из протеолитических ферментов, присутствующих в латексе дынного дерева (Carica papaya L.). Папаин является наиболее изученным ферментом, хотя на его долю приходится только около 5% общего содержания растворимого белка латекса дынного дерева [37].
Папаин - монотиоловая цистеиновая эндопротеаза. По характеру ферментативного действия ее называют «растительным пепсином». Папаин обладает относительно широкой субстратной специфичностью. Папаин преимущественно расщепляет пептидные связи, образованные Гли, Лей, Арг и Лиз. Молекула папаина состоит из одной полипептидной цепи и содержит 212 аминокислотных остатков. Характерной особенностью аминокислотного состава фермента является отсутствие остатков метионина. Молекулярная масса папаина, определенная Э.Смитом и др. на основании скорости седиментации и диффузии, равна 20,7 кДа. Эта величина значительно ниже значения, полученного Болзом и Г. Лайнуивером (27 кДа) осмометрическим методом. Папаин относительно устойчив в нейтральной и слабощелочной среде (диапазон pH 3—12, оптимум pH 5-8), но быстро и необратимо теряет активность в области кислых значений рН. По сравнению с другими протеиназами растительного происхождения папаин проявляет значительную устойчивость к действию повышенных температур. Он сохраняет активность в широком температурном диапазоне (до 50 - 60 °C). Фермент стабилен в лиофилизированном неактивированном состоянии. Потеря активности в водных растворах происходит медленно, но зависит от температуры хранения. Молекула папаина обладает высокой устойчивостью к денатурирующим воздействиям [39, 40].
Молекула фермента имеет близкую к сферической форму и состоит из двух доменов, обозначенных как L- и R-домены. Домены разделены глубоким "желобом", на поверхности которого находится активный центр фермента. Оба домена содержат практически одинаковое число аминокислотных остатков. Так, L-домен включает остатки с 12 по 112 и с 208 по 212, а R-домен - остатки с 1 по 11 и с 113 по 207. Положение одного домена относительно другого поддерживается с помощью трех отрезков полипептидных "хребтов", пересекающих основание "желоба", и множеством водородных связей, а также электростатическими и гидрофобными взаимодействиями боковых групп аминокислотных остатков полипептидной цепи. В L-домене присутствуют три отрезка альфа - спирали, охватывающие остатки 26-41, 50-56 и 69-78, в R-домене - один короткий отрезок α-спирали (остатки 163-172) и небольшой фрагмент β-структуры (остатки 163-172). Центральная область R-домена представляет собой гидрофобное ядро, в котором 12-14 остатки Leu, Val и Phe взаимодействуют между собой. В целом спирализованные участки в молекуле папаина охватывают около 20% всех аминокислотных остатков, входящих в состав белковой молекулы. В молекуле папаина присутствуют пять внутримолекулярных солевых мостиков, образованных гуанидиновыми группами остатков аргинина и карбоксильными группами остатков дикарбоновых аминокислот. Один такой мостик располагается внутри молекулы, а четыре на ее поверхности [42, 43].
На рис. 3 представлена третичная структура папаина.
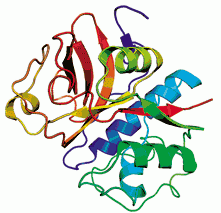
Рис. 3 Третичная структура папаина [41].
2.2.3 Эндогенные протеазы из проросших семян фасоли.
2.2.3.1 Легумаин.
Легумаины – семейство цистеиновых эндопептидаз, специфичные к расщеплению пептидных связей, образованных аспарагином в позиции Р1. Впервые легумаины были обнаружены у бобовых культур. Легумаин осуществляет процессинг легумина. Фермент гидролизует пептидную связь, содержащую карбоксильную группу аспарагина, в пептидах и белках. Все легумаины состоят из одной полипептидной цепи с молекулярной массой 33 – 39 кДа. Оптимум активности очищенного фермента находится в слабокислой области (pH 5 – 5,5). Фермент относительно лабилен, его стабильность ограничена интервалом pH 3 – 6,5 и температурой ниже 40oС. Необратимая инактивация происходит уже в слабощелочной области (pH > 7,5) и температуре 60oС.
Легумаин фасоли LLP относится к цистеиновым протеиназам к клану CD семейству С13. Кажущаяся молекулярная масса LLP составляет 38,1 кДа. Возможно присутствует внутрицепочечная дисульфидная связь в молекуле. Оптимум активности фермента находится при pH 5 – 5.5 и температуре около 30oС.
Все известные к настоящему времени легумаины имеют потенциальные сайты N-гликозилирования в одной и той же области, но не все из них гликозилированы[44].
2.2.3.2 Цистеиновая протеиназа СРРh.
Цистеиновая протеиназа СРРh – это папаиноподобная протеиназа из проросших семян фасоли. Кажущаяся молекулярная масса составляет 30 кДа, оптимум фермента находится в слабокислой области при pH – 5,0. При pH >7 и температуре выше 45oС фермент инактивируется необратимо [45].
