Исследование действия папаина на модифицированный in vivo фазеолин
По результатам гидролиза был также проведен электрофорез, нативный электрофорез и SDS-электрофорез. При протекании гидролиза для двух типов электрофореза брались пробы в установленное время опыта (0`,15`,30`, 60`, 120`, 4h, 24h, 48h). Для SDS-электрофореза пробы гидролизата
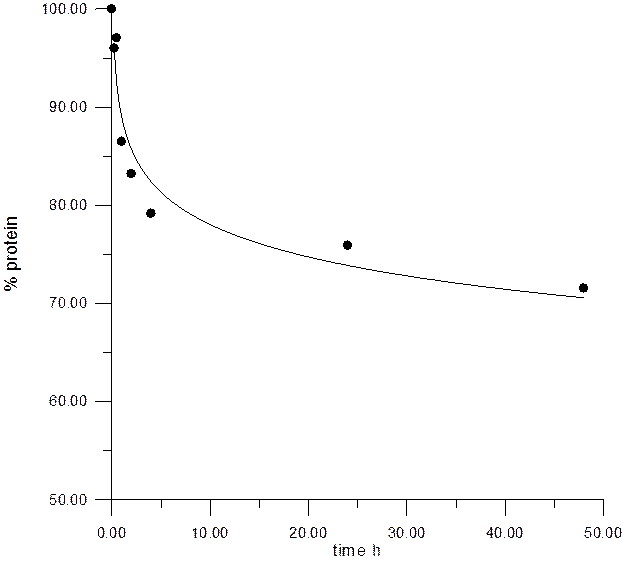
Рис. 5 Гидролиз фазеолина модифицированного invivo под действием папаина.
Черными точками обозначен фазеолин (●), отражена его концентрация в ИС с течением времени.
были подвержены 3-ех минутной обработке на водяной бане при температуре 100oС в присутствии додецилсульфата натрия. Результат SDS-электрофореза отображен на рис.6. Для нативного электрофореза взятые пробы не подвергались температурной обработке без использования додецилсульфата натрия в присутствии IAC. Результаты нативного электрофореза представлены на рисунке 7.
|
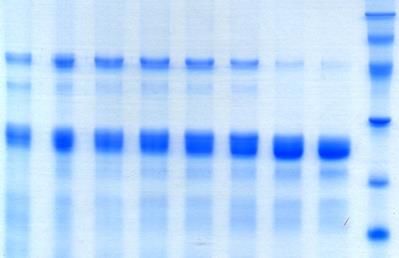
Рис.6 SDS-электрофорез проб гидролиза фазеолина под действием папаина.
Треки пронумерованы от 1 – до 8 в соответствии времени взятия проб (0`,15`, 30`, 60`, 120`, 4h, 24h, 48h). Справа (M) указан набор стандартных маркеров с молекулярными весами (кДа).
Для SDS-электрофореза производился расчет молекулярных масс для проб 4h и 48h. В гидролизате 4h пробы прослеживаются фрагменты белка с молекулярной массой от 15,3 до 45,3 кДа. Наиболее крупные фрагменты имеют молекулярную массу 45,3 и 36,9 кДа. Основное количество составляют фрагменты с молекулярной массой 26,3 и 24,5 кДа, в меньшем количестве обнаружились фрагменты с молекулярной массой 21,1, 16,9 и 15,3 кДа. В пробе 48h количество фрагментов с молекулярной массой в пределах 45,3 – 46 кДа сильно уменьшается, а фрагменты с массой в пределах 36 кДа не прослеживаются вовсе. Для данных (4h и 48h) и предыдущих проб хорошо прослеживается уменьшение, в плоть до исчезновения некоторых фрагментов (в пробе 48h) с приблизительной молекулярной массой 36 - 46 кДа, что, по всей видимости, означает их почти полное расщепление к 48 часам гидролиза. Одновременно с этим в пробе 48h по сравнению с пробой 4h и предыдущими пробами наблюдается более четкое проявление фрагментов с молекулярной массой в пределах 21,3 – 24,4 кДа.
MiF Phas 1 2 3 4 BSA
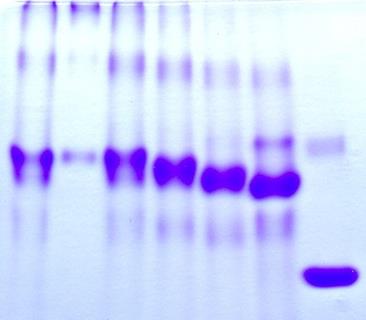
Рис.7 Нативный электрофорез результатов гидролиза фазеолина под действием папаина.
Слева указан модифицированный in vivo фазеолин (MiF) и исходный нативный фазеолин (Phas). Справа указан маркер (BSA). Нумерация треков от 1 до 4 соответствует пробам гидролиза отобранным в 0`, 30`, 4h, 48h.
В отличие от SDS-электрофореза при нативном электрофорезе не происходит денатурации белка и его фрагментов, то есть белок либо отдельные его фрагменты сохраняет нативную структуру и конформацию. Расчет молекулярных масс производился по маркеру BSA и исходному нативному фазеолину (Phas), молекулярная масса которого 140 кДа. Результаты нативного электрофореза также указывают на убыль белка при гидролизе.
4.3 Анализ процесса гидролиза фазеолина папаином.
Как упоминалось ранее, характерная особенность белка фазеолина - это устойчивость к ферментативному воздействию целого ряда экзогенных ферментов, проявляющаяся в устойчивости к глубокому протеолизу. Процесс гидролиза обычно завершается на стадии ограниченного протеолиза. Причиной ограниченного протеолиза фазеолина является жесткость структуры большей части его молекулы, полный гидролиз которой достигается только после глубокой денатурации. Действие папаина на нативный фазеолин показали, что фазеолин не подвергается глубокому гидролизу.
Но что касается 6-ти дневного фазеолина модифи-цированного in vivo, то его протеолиз отличается от протеолиза нативного фазеолина, поскольку имеет место влияние эндогенных протеиназ на нативный фазеолин, во время прорастания семян фасоли. Основные протеиназы влияющие на фазеолин при прорастании – это легумаин и CPPh. Эндогенные протеиназы в течение 6 дней прорастания семян, также не приводят к глубокому протеолизу фазеолина, но в большой мере дестабилизируют молекулу фазеолина инициируя его распад и частично расщепляют субъединицы фазеолина.
Под воздействием папаина на модифицированный in vivo фазеолин также не наблюдается глубокий протеолиз (убыль белка по данным спектрофотометрического метода составила не более 30%, остальную часть составляет исходный не гидролизованный фазеолин). Это также отражается посредством электрофореза проб гидролиза, так по данным SDS-электрофореза на протяжении всего гидролиза в течение 48 часов так и не происходит полное расщепление крупных фрагментов белка с молекулярной массой в пределах 45 кДа, что примерно соответствует субъединицам фазеолина. По данным нативного электрофореза убыль белка также незначительна, основная часть белка с молекулярной массой в пределах 120 – 130 кДа сохраняются в наибольшем количестве, с отщеплением небольших по молекулярной массе фрагментов от молекулы фазеолина. Таким образом, на протяжении гидролиза убыль белка происходит в основном только за счет отщепления сравнительно небольших участков (фрагментов) от молекулы фазеолина что, по всей видимости, и соответствует ограниченному протеолизу.
5. Выводы.
1) Нативный фазеолин весьма специфичен по сравнению с другими запасными белками, устойчив и не подвержен глубокому гидролизу рядом ферментов экзогенного происхождения.
2) Фазеолин модифицированный in vivo в большей степени подвержен гидролизу папином, нежели нативный, по причинам дестабилизации четвертичной структуры молекулы во время мобилизации белка при прорастании семян, в результате действия протеиназ эндогенного происхождения, таких как легумаин и CPPh, и возможно ряда других протеиназ.
3) При действии папаина на модифицированный in vivo фазеолин, папаин не приводит к глубокому протеолизу фазеолина, что подтверждается относительно не высоким процентом гидролизованного белка (30%) в инкубационной смеси.
4) На протяжении гидролиза происходит отщепление относительно небольших пептидных фрагментов от молекулы фазеолина.
5) Гидролиз фазеолина модифицированного in vivo под действием папина носит ограниченный характер.
6. Литература.
1. Brown L.R. The Changing World Food Prospect: The nine Tenth and Beyond // World watch Paper 85, October, Washington D.C. – 1998.
2. Chimirov Y.I., Sologub L.P., Brando E.E., Kozmina E.P., Tolstoguzov V.B. Utilization of structurized oil seed proteins in minced meat products // Nahrung, 1981, v.25, p. 255 – 262.
