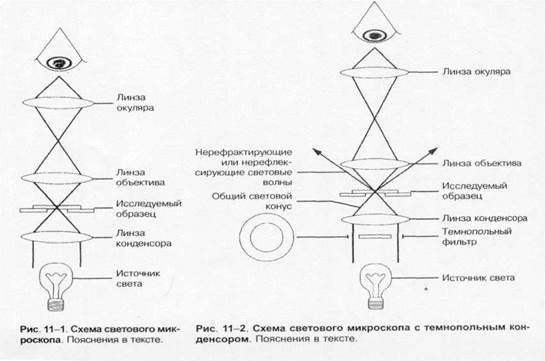
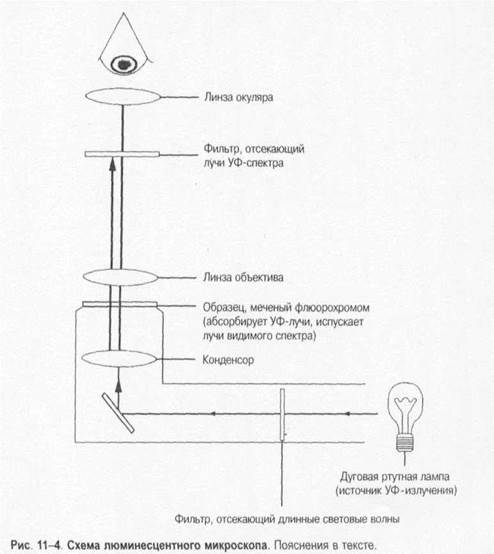
Методы микробиологической диагностики
|
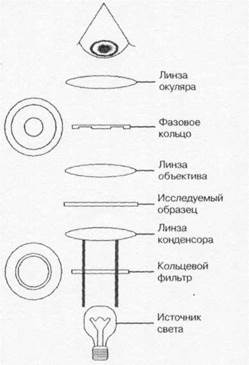
Рис. 1-3. Схема фазово-контрастного микроскопа |
Электронная микроскопия
Теоретически разрешение просвечивающего электронного микроскопа составляет 0,002 нм; реальное, разрешение современных микроскопов приближается к 0,1 нм. На практике разрешение для биологических объектов достигает 2 нм.
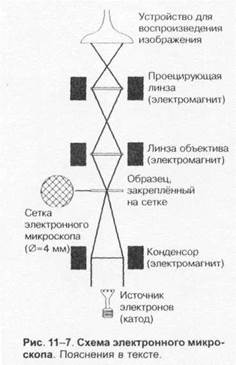
Просвечивающий электронный микроскоп
(рис. 1-7) состоит из колонны, через которую в вакууме проходят электроны, излучаемые катодной нитью. Пучок электронов, фокусируемый кольцевыми магнитами, проходит через подготовленный образец. Характер рассеивания электронов зависит от плотности образца. Проходящие через образец электроны наблюдают на флюоресцирующем экране и регистрируют при помощи фотопластинки.
Сканирующий электронный микроскоп применяют для получения трёхмерного изображения поверхности исследуемого объекта.
Подготовка материала к микроскопии
В бактериологической практике микроскопически исследуют неокрашенные образцы (нативный материал) и окрашенные препараты (мазки или мазки-отпечатки), приготовленные из клинического материала или колоний выросших микроорганизмов.
Нативные препараты
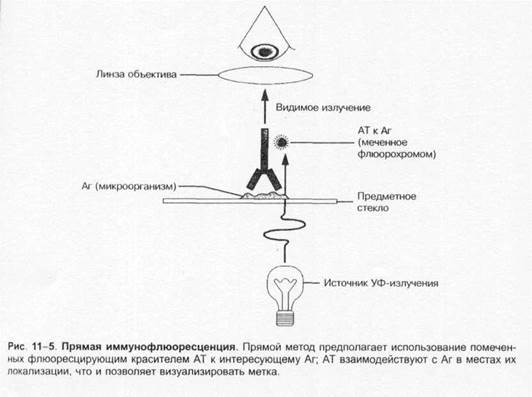
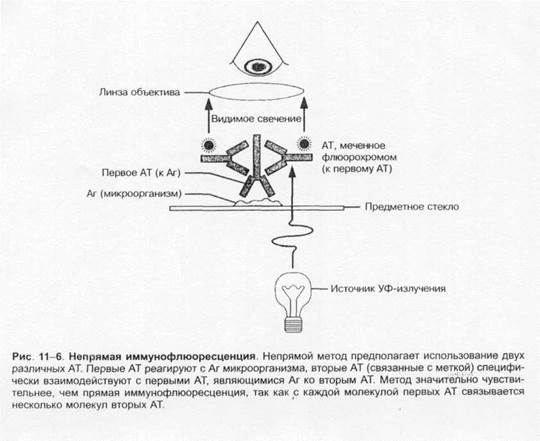
Нативные препараты готовят для исследования живых неокрашенных бактерий. Наибольшее распространение получили метод висячей капли, микрокамеры с плотными средами и негативные методы исследования живых бактерий. Для прижизненного исследования также часто применяются исследование в тёмном поле и фазово-контрастная микроскопия. Подобные приёмы часто используют для диагностики сифилиса и предварительной диагностики диарей, вызванных кампилобактерами, а также для определения подвижности микроорганизмов.
Окрашенные препараты
![]() Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.
Для приготовления окрашенных препаратов из исследуемого объекта готовят мазки и фиксируют их.
Отбор материала. Тампоны, содержащие микроорганизмы, прокатывают по предметному стеклу (рис. 1-8, А); с их помощью также готовят мазки из непрозрачных жидкостей, например взвеси испражнений (рис. 1-8, Б). Мазки из материалов со слизистой или грубой консистенцией готовят растиранием их между двумя предметными стёклами (рис. 1-9). Прозрачные жидкости (например, мочу или СМЖ) можно нанести в виде капли на предметное стекло (рис. 1-10, А), при этом границы капли желательно обвести маркёром. Лучшие результаты даёт предварительное центрифугирование; затем осадок наносят на стекло; если он густой, его можно распределить с помощью стеклянной палочки (рис. 1-10, Б).
Фиксация. В практической бактериологии наиболее распространена термическая фиксация (над пламенем горелки) — метод грубый, но сохраняющий морфологию и отношение к красителям у бактерий. Для более детального изучения структуры клеток применяют фиксирующие растворы, предотвращающие ферментативный аутолиз бактерий и стабилизирующие макромолекулы путём химического их сшивания. Для светооптической микроскопии используют формалин, спирты, глутаральдегид, жидкость Карнуа, ацетон, пары осмиевой кислоты и др. Мазки фиксируют, помещая их в раствор фиксатора или нанося фиксаж на мазок. Для электронной микроскопии применяют глутаральдегид и тетраоксид осмия.
Окрашивание. Стандартные красители, используемые для окраски бактерий, — карболовый фуксин Циля, фуксин Пфайф-фера и метиленовый синий по Лёффлеру. Для получения более информативных результатов в светооптической микроскопии используют специальные и дифференцирующие методы окраски.
|
|
|
|
Специальные методы окраски бактерий. Наибольшее распространение нашли методы Грама и Циля-Нильсена (рис. 1-11).
Дифференцирующие методы обычно применяют для окрашивания различных морфологических структур.
Капсулы. Для окраски капсул бактерий применяют методы Хисса, Лейфсона и Антони; последний метод наиболее прост и включает окраску кристаллическим фиолетовым с последующей обработкой 20% водным раствором CuSO4.
Жгутики. Для окраски жгутиков предложены методы Лёффлера, Бейли, Грея и др. Для этих методов характерны первоначальное протравливание препарата [обычно растворами таннина, KAl(SO4)2, HgCl2] и последующая окраска (чаще карболовый фуксин Циля).
Споры. Окраску спор бактерий проводят после предварительной обработки их стенок. Наиболее прост метод Пешкова, включающий кипячение мазка с синькой Лёффлера на предметном стекле с последующей докраской нейтральным красным. Споры окрашиваются в синий цвет, вегетативные клетки — в розовый.
Питательные среды для культивирования бактерий
Для выделения чистых культур патогенных бактерий применяют оптимальные для их роста питательные среды с фиксированным рН. Большинство бактерий способно расти на различных питательных средах; исключение составляют хламидии и риккетсии, не растущие in vitro вне клеточных культур. Используемая среда должна содержать
|
|
- вещества, утилизируемые бактериями для различных биосинтетических процессов.
Универсальные источники азота и углерода — бел- ковые гидролизаты (содержат полный набор аминокис- лот), пептиды и пептоны. Универсальные источники витаминов и микроэлементов — экстракты белков жи- вотного или растительного происхождения и белковые гидролизаты.
рН среды. В некоторых случаях жизнедеятельность бактерий сопровождается сдвигом рН в кислую или щелочную сторону, что требует внесения в среды раз- личных буферных систем (обычно применяют фосфат- ный буфер). Сбалансированные среды отличают высо- кая буферность и стабильный оптимум рН. Важно так же создание оптимальной концентрации О2 и СО2. ;
Классификации сред
Среды классифицируют по консистенции, составу, происхождению, назначению и загрязнённости материала.
По консистенции питательные среды разделяют на плотные (твёрдые), полужидкие и жидкие.
По составу выделяют белковые, безбелковые и минеральные среды.
По происхождению среды разделяют на искусственные и естественные (природные).