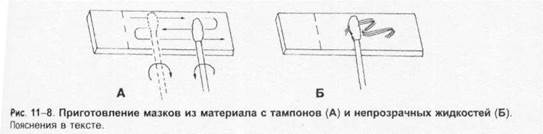
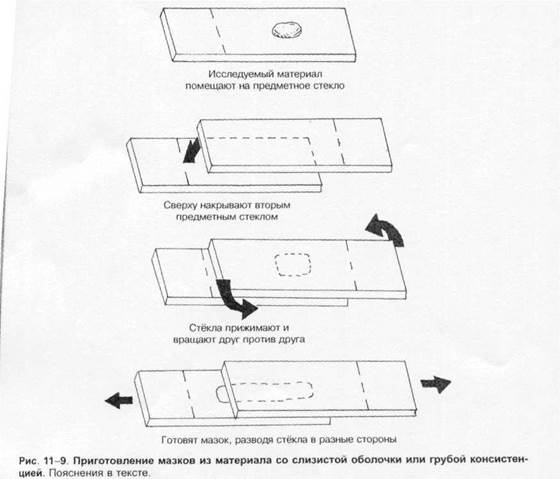
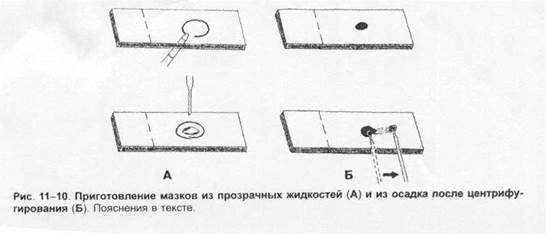
Методы микробиологической диагностики
Искусственные среды разделяют на животные [например, мясопептонный агар (МПА) или мясопептонный бульон (МПБ)] и растительные (например, настои сена и соломы, отвары злаков, дрожжей или фруктов, пивное сусло и др.).
|
|
|
|
|
|
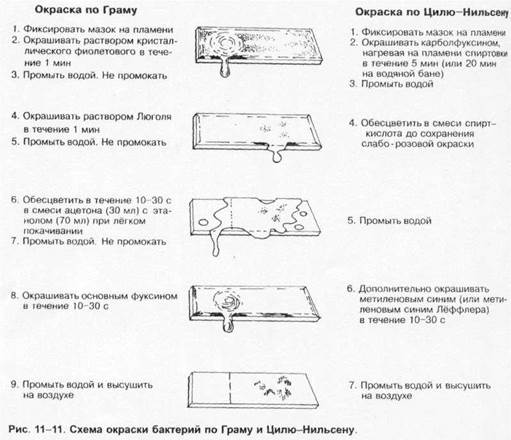
![]() Естественные среды могут содержать компоненты животного (например, кровь, сыворотка, жёлчь) или растительного (например, кусочки овощей и фруктов) происхождения.
Естественные среды могут содержать компоненты животного (например, кровь, сыворотка, жёлчь) или растительного (например, кусочки овощей и фруктов) происхождения.
По назначению выделяют консервирующие среды (для первичного посева и транспортировки), среды обогащения (для накопления определённой группы бактерий), среды для культивирования (универсальные простые, сложные специальные и для токсинообразования), среды для выделения и накопления (консервирующие, обогащения и элективные) и среды для идентификации (дифференциальные и элективно-дифференциальные).
По загрязнённости материала. Если материал слабо загрязнён посторонней микрофлорой, то для выделения чистых культур применяют простые (по составу) среды. При обильной контаминации сапрофитами используют специальные или элективные (для отдельных видов), селективные (только для отдельных бактерий), дифференциально-диагностические (для облегчения идентификации) среды.
Характеристики сред
Консервирующие среды предупреждают отмирание патогенов и подавляют рост сапрофитов. Наибольшее применение нашли глицериновая смесь (среда Тига), гипертонический раствор, глицериновый консервант с LiCl2, раствор цитрата натрия и дезоксихолата натрия (среда Бенгсанга-Эллиота).
Среды обогащения (например, среда Китта-Тароцци, селенитовый бульон, тиогликолятная среда) применяют для накопления определённой группы бактерий за счёт создания условий, оптимальных для одних видов и неблагоприятных для других. Наиболее часто в качестве подобных агентов используют различные красители и химические вещества — соли жёлчных кислот, тетратионат Na+, теллурит К+, антибиотики, фуксин, генциановый фиолетовый, бриллиантовый зелёный и др.
Элективные и селективные среды (например, среды Уйлсона-Блэра, Эндо, Плбскирева, Мак-Конки) предназначены для первичного посева материала или для пересева с консервирующих сред или сред обогащения с целью получения чистой культуры. Среды готовят с учётом биохимических и энергетических потребностей микроорганизмов. Соответственно, выделяют кровяные и сывороточные среды (например, Лёффлера, Бордё-Жангу), яичные среды (например, Лёвенштайна-Йенсена) и др
Дифференциально-диагностические среды (например, среды Хисса, Кларка) применяют для изучения и идентификации отдельных типов, видов и групп бактерий. В качестве основы применяют различные органические и неорганические соединения, гидролизаты казеина, пептонную воду, бульон Хоттингера-Мартена, дополненные углеводами, спиртами, мочевиной и другими веществами; при их расщеплении происходит сдвиг рН в кислую (углеводы, спирты, липилы) или щелочную (белки) сторону. Соответственно, выделяют среды с углеводами и спиртами, среды с мочевиной, среды для определения индолообразования, среды для определения протеолитической активности и комбинированные (политропные) среды. В такие среды также часто вносят различные индикаторы (например, бромтимоловый синий, индикатор Андраде, бромкрезоловый пурпурный и крезоловый красный), помогающие визуально определить изменение рН, характерное для различных микроорганизмов. В частности, сдвиг в кислую сторону вызывает покраснение среды с реактивом Андраде или пожелтение при использовании среды с бромтимоловым синим, тогда как при защелачивании реактив Андраде и индикатор бром-тимоловый синий не меняют цвет среды. Все дифференциально-диагностические среды разделяют на четыре основные группы.
Среды, содержащие белки, дающие характерные изменения под действием бактериальных ферментов (кровь, желатина, молоко и др.), применяют для определения гемолитических или протеолитических свойств. Наиболее распространены мясопептонная желатина (МПЖ), свернувшаяся лошадиная сыворотка, молоко и кровяной агар (КА).
Среды, содержащие углеводы или многоатомные спирты. Ферментативное расщепление субстратов приводит к сдвигу рН и изменению окраски среды, а иногда и образованию газа. Наиболее распространены цветные среды с различными углеводами (например, с бром-тимоловым синим, индикатором ВР), лакмусовое молоко (среда Минкевича) и среды Хисса. Из углеводов наиболее часто используют моносахариды (ксилозу, арабинозу, глюкозу, фруктозу, маннозу, галактозу), дисахариды (лактозу, мальтозу, сахарозу), полисахариды (крахмал, гликоген, инулин, декстрин), спирты (дульцит, маннит, сорбит, глицерин) и гликозиды (адонит, инозит, салицин, амигдалин).
Среды для определения редуцирующей способности. В эту группу входят среды с красками, обесцвечивающимися при восстановлении (например, метиленовый голубой, нейтральный красный, индигокармин), а также среды с нитратами для определения денитрифицирующей активности бактерий (при положительном результате среды окрашиваются в синий цвет).
Среды, включающие вещества, ассимилируемые только определённой группой бактерий. Наиболее известны цитратный агар Симмонса и цитратная среда Козера.
Посев и культивирование
При достаточном содержании патогенных бактерий в образце проводят посев на плотные питательные среды (для получения изолированных колоний). Если в исследуемом материале бактерий мало, то посев проводят на жидкие среды обогащения. На практике выделение относительно неприхотливых бактерий обычно проводят на простых средах (например, на КА, агаре Плоскирева, тиогликолевом бульоне, агаре Сабуро и т.д.). Для выделения прихотливых видов в среды вносят питательные вещества (кровь, сыворотку, дрожжевой экстракт и др.), а также поглотители токсических метаболитов, образующихся при росте бактерий (например, древесный уголь). Для посевов применяют микробиологические петли, реже иглы и шпатели.
Получение изолированных колоний
Для получения изолированных колоний на практике наиболее часто используют модификацию рассева по Дригальски. Для этого материал наносят на поверхность плотной питательной среды ближе к краю и делают «бляшку». Затем из неё материал распределяют по четырём квадратам, проводя петлёй штрихи, как показано на рис. 1-12, обжигая петлю после засева каждого квадрата. Подобный метод позволяет получить изолированные колонии и изучать их. Исключение составляет техника посева при бактериологическом исследовании мочи (техника штрихового засева показана на рис. 1-13). Указанные методы пригодны для посева аэробных и факультативно анаэробных бактерий, а также нестрогих анаэробов.