Микроорганизмы, выделенные из различных природных жиров
Метод используется в растворах белков с концентрацией от 0,04 до 1,6 мг/см3.
Необходимые реактивы. Биуретовый реактив – в мерную колбу на 1 дм3 наливают 400 см3 0,2н раствора NaOH, добавляют 9г калия-натрия виннокислого, перемешивают до полного растворения, добавляют 3г сульфата меди (порошка) и 5г йодистого калия, объем доводят до метки 0,2н раствором NaOH; раствор мочевины – к 300г мочевины (карбамида) прибавляют кусочек тимола величиной с горошину, приливают 700 см3 дистиллированной воды и смесь нагревают, затем прибавляют 3г активного угля, перемешивают фильтруют в мерную колбу на 1 дм3, объем доводят до метки дистиллированной водой.
Техника определения. В пробирку наливают 2,4см3 раствора мочевины, 0,1см3 раствора белка и 2,5см3 биуретового реактива. Смесь хорошо перемешивают и пробирки помещают в водяную баню при температуре 40оС на 10 минут. Затем их охлаждают до 20оС. Через 30 минут после добавления биуретового реактива раствор колориметрируют на ФЭК при длине волны 540нм. Количество белка находят по калибровочной кривой, составленной по яичному альбумину.
Для построения калибровочной кривой готовят исходные водные растворы с содержанием 10, 20, 30, 40, 50, 60 мг белка в 10см3. Из полученных растворов отбирают в пробирки по 0,1см3, добавляют 2,4см3 раствора мочевины и 2,5см3 биуретового раствора и ведут определение описанным выше методом. Калибровочный график представлен на рисунке 3
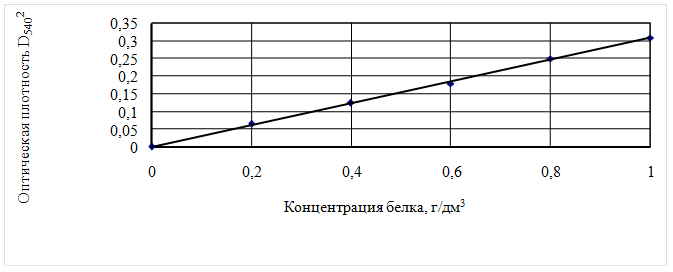
Рисунок 3 – Калибровочный график зависимости оптической плотности от содержания белка
2.2.14 Метод определения протеолитической активности (ПС) Вильштеттера и Вальдшмидт-Лейтца в модификации
Метод основан на определении свободных карбоксильных групп в спиртовых растворах аминокислот и полипептидов.
Активность (ПС) выражают количеством миллиграммов аминного азота, которое образуется при гидролизе определенного количества 5%-ного раствора желатина с рН 7,3-7,5 1г препарата или 1см3 ферментного раствора за 1 час при температуре 40оС.
За единицу протеолитической активности принимают количество фермента, которое образует 1мг аминного азота за 1 час в принятых условиях опыта.
Необходимые реактивы. Фосфатный буферный раствор с рН 7,3-7,5; 5%-ный раствор желатина, приготовленный на основе буферного раствора, перед употреблением раствор желатина нагревают на водяной бане до 40оС; 1%-ный спиртовой раствор тимолфталеина; 0,1н раствор гидроксида натрия; 96%-ный этиловый спирт.
Техника определения. К 10см3 5%-ного раствора желатина с рН 7,3-7,5 приливают 2см3 испытуемого ферментного раствора и сразу же отбирают 1см3 реакционной смеси в коническую колбу на 50-100см3, куда предварительно налито 20см3 96%-ного этилового спирта и 0,2см3 1%-ного раствора тимолфталеина. Пробу тут же титруют 0,1н раствором гидроксида натрия. После появления голубой окраски в растворе прибавляют еще 4 капли щелочи и на этом титрование заканчивают. Титрование проводят из микробюретки с ценой деления 0,02см3.
Оставшуюся смесь желатина с ферментным раствором помещают в термостат с температурой 40оС для гидролиза. Через 3 часа 1см3 реакционной смеси отбирают во вторую коническую колбочку на 50-100см3, куда предварительно налито 20см3 96%-ного этилового спирта и 0,2см3 1%-ного раствора тимолфталеина и титруют аналогично контролю.
Расчет протеолитической активности ПС ведут по формуле (2):
ПС = ![]() , (2)
, (2)
где ПС – протеолитичсекая активность, ед/г;
А – количество аминного азота, накопленное за время опыта в реакционной смеси, мг;
t – время протеолиза, ч;
Р – коэффициент, учитывающий разведение и пересчет на 1г препарата или 1см3 жидкого ферментного раствора.
Величина А рассчитывается по формуле (3):
А=(а-ак)×1,4×К, (3)
где A – количество аминного азота, мг;
а – количество 0,1н раствора NaOH, пошедшее на титрование 1см3 опытной пробы, см3;
ак – то же, для контрольной пробы;
1,4 – коэффициент пересчета количества 0,1н раствора щелочи в миллиграммы азота аминокислот и полипептидов;
К – поправка к титру щелочи.
2.2.15 Определение активности липазы (ЛС) (модифицированный метод Ота, Ямада)
За единицу ферментативной активности липазы принимают такое количество фермента, которое освобождает 21мкмоль олеиновой кислоты из 40%-ной эмульсии оливкового масла при рН 7,0 и температуре 37оС в течении 1часа.
Метод основан на определении путем титрования щелочью жирных кислот, образовавшихся под действием липазы при использовании в качестве субстрата оливкового масла.
Необходимые реактивы. Раствор оливкового масла (субстрат); 2%-ный раствор поливинилового спирта; 1н раствор соляной кислоты (HCl); 0,05н раствор гидроксида натрия (NaOH); фосфатно-цитратный буфер с рН 7,0; 1%-ный раствор фенолфталеина; 90%-ный раствор спирта; 1%-ный раствор фермента.
Техника определения. 5см3 эмульсии субстрата и 4см3 буфера с рН 7,0 помещают в колбу Эрленмейера на 100см3, которую закрывают пробкой. Смесь выдерживают на водяной бане при температуре 37оС в течении 10 минут. Затем к смеси добавляют 1см3 раствора фермента и хорошо перемешивают. Полученную смесь выдерживают при температуре 37оС в течении 1 часа, после чего немедленно добавляют 30см3 этанола для прекращения реакции. Раствор титруют 0,05н раствором NaOH в присутствии 1%-ного раствора фенолфталеина до исчезновения окраски.
Контрольную пробу готовя следующим образом. К смеси субстрата и буфера с рН 7,0, выдержанной при температуре 37оС, добавляют 30см3 этанола, затем 1см3 ферментного раствора и смесь немедленно титруют.
Разность между результатами титрований контрольной и опытной проб соответствует количеству 0,05н раствора NaOH, которое пошло на нейтрализацию жирных кислот, образовавшихся из оливкового масла под действием фермента.
Липазную активность фермента ЛС (в ед/г) определяют по формуле (4):
ЛС=![]() , (4)
, (4)
где ЛС – липолитическая активность, ед/г;
А – разность между результатами титрований опытной и контрольной проб, см3;
Т – титр щелочи;
В – концентрация образца ферментного раствора, г/см3.
2.2.16 Определение концентрации взвешенных веществ
Предварительно готовят фильтры следующим образом: промывают горячей водой (дистиллированной), затем высушивают до постоянного веса в сушильном шкафу при температуре 105оС.
Для определения содержания взвешенных веществ их отделяют, фильтруя сточную воду, объемом 50-100 см3 через бумажный фильтр средней плотности, доведенный до постоянного веса. Оставшийся на стенках стакана осадок смывают небольшой порцией фильтрата и переносят на фильтр. Осадок смывают небольшим количеством (10-15 см3) спиртоэфирной смеси для удаления веществ, сорбированных на поверхности взвешенных веществ. Фильтр с осадком помещают в тот же бюкс, в котором его взвешивали до фильтрования, и высушивают в сушильном шарфу при температуре 105оС в течение 2 часов. Бюкс закрывают крышкой и охлаждают в эксикаторе над прокаленным хлоридом кальция. Затем взвешивают с абсолютной погрешностью не более 0,0002 г.
