Вода и ее применение в современных технологияхРефераты >> Технология >> Вода и ее применение в современных технологиях
Лучше всех из современных мыслителей значение воды определил крупнейший ученый, основоположник ряда новых научных дисциплин, биохимик и минера' лог, академик В. И. Вернадский: «Вода стоит особняком в истории нашей планеты. Нет природного тела, которое могло бы сравниться с ней по влиянию на ход основных, самых грандиозных, геологических процессов. Нет земного вещества—минерала, горной породы, живого тела, которое ее бы не заключало. Все земное вещество . ею проникнуто и охвачено» [1960,с. 16].
Глава 1 Физические свойства воды.
Среди всех веществ, изучаемых физиками и
физико-химиками, вода во многих
отношениях является самым трудным.
В. В. Шуленкин, 1968
1.1 Чистая вода.
Разумеется, под чистой водой мы подразумеваем не санитарно безупречную жидкость, а воду, отвечающую по составу привычной нам со школьной скамьи химической формуле Н2О. При этом относительная атомная масса водорода, входящего в состав соединения, равна 1, а кислорода 16, никаких других веществ в форме растворенных или взвешенных примесей вода не содержит. Такой окиси водорода, состоящей из двух весовых частей водорода и шестнадцати весовых частей кислорода, в природе в чистом виде не существует, да и искусственно получить такое вещество даже в современных лабораториях крайне трудно, а если и возможно, то только на очень короткий отрезок времени, измеряемый секундами. [3]
Природная вода, где бы она ни находилась и в каком бы агрегатном состоянии (газообразном, жидком или твердом) ни была, всегда представляет собой раствор других веществ, газообразных, жидких или твердых, а также содержит подчас в незначительных количествах другие воды (с другими относительными атомными массами водорода и кислорода и другими свойствами). Стало быть, вода — понятие собирательное.
 |
Можно было бы предполагать, что атом кислорода и два атома водорода в молекуле воды образуют у центрального атома кислорода угол, близкий к 180°. Однако в действительности он значительно меньше — всего 104° 27' (рис. 2), что приводит к неполной компенсации внутримолекулярных сил, избыток которых обусловливает асимметрию распределения зарядов, создающую полярность молекулы воды. Эта полярность у воды, более значительная, чем других веществ, обусловливает ее дипольный момент и диэлектрическую проницаемость. Последняя у воды весьма велика и определяет интенсивность растворения водой различных веществ. При 0°С диэлектрическая проницаемость воды (в твердой фазе) составляет 74,6; с повышением температуры она падает. Так, при 20° С диэлектрическая проницаемость воды равна 81.
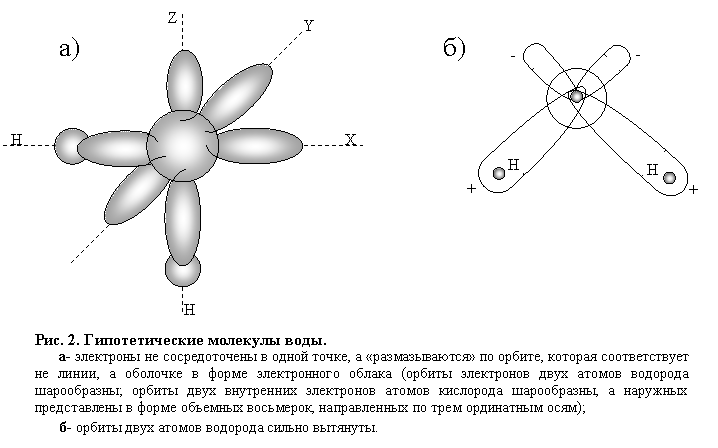 Многочисленные схемы строения молекулы воды являются гипотетическими, построенными на косвенных наблюдениях приборами некоторых признаков поведения и свойств молекул и атомов. При этом следует помнить, что ни атомы, ни молекулы не имеют четких границ размеров орбит, по которым движутся электроны, образующие по сути дела электронное облако, зависящее от энергетического состояния электрона (рис.2).
Многочисленные схемы строения молекулы воды являются гипотетическими, построенными на косвенных наблюдениях приборами некоторых признаков поведения и свойств молекул и атомов. При этом следует помнить, что ни атомы, ни молекулы не имеют четких границ размеров орбит, по которым движутся электроны, образующие по сути дела электронное облако, зависящее от энергетического состояния электрона (рис.2).
1.2
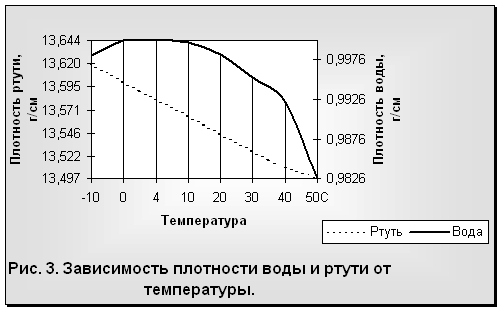 |
Несмотря на то что вода — вещество, принятое в качестве эталона меры плотности, объема и т. д. для других веществ, сама вода, как это не странно, является самым аномальным среди них. Этих удивительных аномалий у воды много, рассмотрим лишь основные из них.
Общеизвестно, что все вещества при нагревании увеличивают свой объем и уменьшают плотность. У воды наблюдается то же самое, за исключением интервала от 0 до 4°С, когда с возрастанием температуры объем воды не увеличивается, а, наоборот, сокращается. Максимальная плотность отмечается при 4°С (рис. 3). Таким образом, для воды зависимость между объемом и температурой не однозначна (как в нормальных условиях для других веществ), а двузначна. Например, при 3 и 5°С масса воды занимает один и тот же объем, так же как и при 0, 2 и 8 °С и т. д. Несмотря на указанную аномалию, вода служит эталоном плотности при 4°С, когда 1 см3 ее имеет массу 1 г.
Что же будет происходить с объемом воды при дальнейшем понижении температуры? Оказывается, что ниже 0°С он продолжает увеличиваться, но только при условии переохлаждения. Однако переохлаждение требует исключительных условий: полной неподвижности воды и отсутствия центров кристаллизации льда (пыли, кристалликов льда и т. п.) (рис. 4).
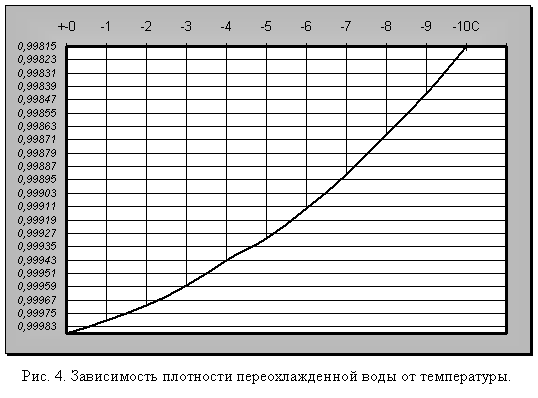 Вода, лишенная растворенных газов, может быть переохлаждена до минус 70 °С без превращения в лед. При легком встряхивании либо при введении льдинки или другого центра кристаллизации она мгновенно превращается в лед и температура ее подскакивает (на 70 °С) до 0°С. Вода также может быть доведена до 150 °С без закипания. При введении в такую перегретую воду пузырька воздуха она мгновенно вскипает, и температура ее падает до 100°С.
Вода, лишенная растворенных газов, может быть переохлаждена до минус 70 °С без превращения в лед. При легком встряхивании либо при введении льдинки или другого центра кристаллизации она мгновенно превращается в лед и температура ее подскакивает (на 70 °С) до 0°С. Вода также может быть доведена до 150 °С без закипания. При введении в такую перегретую воду пузырька воздуха она мгновенно вскипает, и температура ее падает до 100°С.
При замерзании объем воды возрастает внезапно примерно на 11% и так же внезапно, скачком, уменьшается в обратном направлении при таянии льда при
превращении ее в лед происходит расширение объема, что приводит к возникновению избыточного давления, достигающего, как показывают наблюдения, 2500 кгс/см2. Именно этим объясняются как разрушительная сила замерзающей воды в замкнутых пустотах, трещинах горных пород, откалывающая подчас многотонные глыбы и дробящая их в дальнейшем на мелкие осколки, так и страшные взрывы наледей, описание которых будет приведено ниже, а также разрывы водопроводных труб при замерзании в них воды.
Здесь следует сделать одну существенную оговорку. Все рассмотренные выше процессы происходят при указанных температурах лишь при условии абсолютного давления, равного 1 атм. С увеличением давления температура замерзания воды понижается примерно на 1 °С через каждые 130 атм. Так, при давлении 500 атм замерзание наступает при температуре минус 4 °С, а при давлении 2200 атм — при минус 22 °С. Эта зависимость для воды аномальна, так как у других веществ, наоборот, с ростом давления температура замерзания повышается. Подобная аномалия воды очень важна в природе. Даже без учета растворенных в воде солей на больших глубинах в океане вода не замерзает, например при температуре минус 3°С она не замерзнет даже на глубине около 4000 м, а на больших глубинах тем более.
