Вода и ее применение в современных технологияхРефераты >> Технология >> Вода и ее применение в современных технологиях
Электролитический раствор серебра служит эффективным средством при лечении воспалительных и гнойных процессов, желудочно-кишечных заболеваний, язвенной болезни, холецистита, воспаления глаз, носоглотки, ожогов и т. п.Он применяется также в ветеринарии для профилактических и лечебных целей.
Глава 2 Химические свойства воды.
2.1 Характеристика природной воды.
До сих пор мы рассматривали особенности «чистой» воды, не существующей в природе. Теперь мы попытаемся дать пока краткую характеристику природной воды, в которой всегда растворены различные газообразные и твердые (а подчас и жидкие) вещества, создающие громадное разнообразие (по минеральному составу) природных растворов.
По содержанию в 1 л воды растворенных веществ различают три группы вод:
Таблица 1
Содержание в 1л. воды растворенных веществ
|
Кол-во растворенных веществ, г | |
|
Пресные | Менее 1 |
|
Минерализованные | 1-50 |
|
Рассолы | Более 50 |
В воде могут раствориться все элементы периодической системы, включая и такие почти не растворимые, как кремень (например, кварц – двуокись кремния SiO2). Все зависит от температуры, давления и присутствия в растворе других компонентов. Природные воды могут существовать в температурных пределах от близкой к абсолютному нулю (минус 273 °С, или 0°К) до примерно 2000 °С; могут испытывать давление от тысячных долей атмосферы (единицы миллиметров ртутного столба или единицы миллибар) до десятков тысяч атмосфер (порядка 30—40кбар).
2.2 Растворимость газов в воде
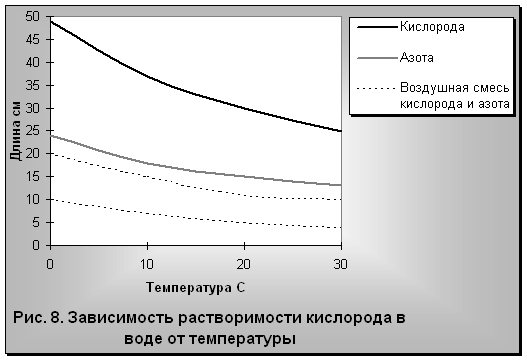
В природной воде могут быть растворены газы как воздушного (атмосферного), так и подземного происхождения. В наиболее пресной дождевой воде, прежде всего, растворяются кислород и азот. Как известно, воздушная смесь газов земной атмосферы в основном состоит из 79 частей азота и 21 части кислорода. Хотя растворимость кислорода почти в два раза выше растворимости азота, все же в воде азота растворяется почти в два раза больше, чем кислорода (рис. 8).
Растворимость в воде газов различна и зависит от ряда факторов: температуры, давления, минерализации, присутствия в водном растворе других газов. С повышением температуры до 90 °С растворимость газов в воде снижается, а затем возрастает. Так, в 1 л воды при температуре 20 °С растворяется 665 мл 4630, аммиака—I 300000. Как видно из этих примеров, растворимость зависит и от состава самого газа.
Повышение давления влечет за собой увеличение растворимости газов. Например, при давлении 25атм в 1 л воды растворяется углекислого газа 16,3 л, а при 53 атм — 26,9.
При повышении минерализации воды растворимость газа падает. Так, при 0°С растворимость кислорода в 1 л воды с минерализацией менее 1 г/л составляет 49 мл, а при минерализации 30 г/л*—только 15, т. е. в три раза меньше.
 |
В растворенном газе дождевой воды углекислоты в 33 раза больше, чем в воздухе, а кислорода в два раза больше.
Углекислый газ поступает в атмосферу (наземную и подземную) преимущественно за счет окисления, брожения и гниения органических остатков и дыхания водных организмов. В атмосфере его содержание при парциальном давлении 0,0003 атм невелико - около 0,03%.
В 1 л чистой воды при таком давлении и температуре 15 °С может раствориться всего лишь 0,59 мг углекислого газа. В земных недрах на значительных глубинах его содержание может достигать очень больших значений, и источником этого газа чаще служат глубинные процессы выделения его из вещества мантии и нежней литосферы.
2.3 Растворимость твердых веществ в воде.
Процесс растворения твердых веществ в воде можно рассматривать как борьбу двух электростатических сил с противоположными зарядами, присущих ионам твердого вещества, с одной стороны, и ионам и молекулам воды — с другой. На рис. 9 показана схема процесса растворения кристалла поваренной соли (NaCI). Оторванные от кристалла заряженные ионы хлора и натрия окружаются молекулами воды и образуют вокруг иона твердого вещества гидратную оболочку. Иногда она сохраняется даже в том случае, когда твердое вещество выпадает из насыщенного раствора в осадок. Например, выпадающий из раствора при его пересыщении сульфат кальция (Са[S04]) захватывает воду (называемую кристаллизационной) и становится гипсом (Ca[S04] · 2H20). Процесс может идти и в обратную сторону. Аналогичное происходит и с гематитом (железным блеском Fe2Оз), переходящим при гидратации в лимонит (бурый железняк HFeO2 · nH2O, где п достигает 4) и т. п.

Процессы гидратации могут происходить настолько быстро и сопровождаться столь значительным увеличением объема, что приводят к нарушениям земной коры, подобно тектоническим дислокациям.
Растворы представляют собой сложные промежуточные системы между физическими смесями и химическими соединениями. Процесс растворения — процесс диффузионный. При достижении предела растворения (при известных температуре и давлении) наступает динамическое равновесие между количествами как растворяемого вещества, так и выпадающего из раствора, образуется насыщенный, или концентрированный, раствор. Д. И. Менделеев относил процесс растворения не к физическим, а к химическим процессам на том основании, что нередко при растворении выделяется тепло. Это происходит вследствие химического взаимодействия между растворяемым веществом и растворителем. Процентное содержание воды в некоторых минералах очень велико. Например, мирабилит Na2S04·10H20 содержит 56 вес. % воды, гидробазалюминит А14[(ОН)10SO4]3 · 36Н2O — 60, сода Na2СOз·10H2О — 55 и т. д.
Твердое вещество образует водный раствор из молекул и ионов с диаметром 1—10А. Но в воде могут содержаться и более крупные частицы: от 10 до 100А, которые образуют чаще всего не истинные, а коллоидные растворы. Если находящиеся в воде частицы еще крупнее, то они не образуют растворов, а создают механические суспензии, взвеси.
