Изучение взаимодействия в системе NaF-Bi2O3-BiF3 при 600 и 650 градусах Цельсия
В работе [14] масс-спектральным методом исследована область гомогенности оксида висмута (III) при 1070 К. Изучением равновесия "газ – твердая фаза" в платиновой ячейке установлено, что при этой температуре оксид висмута может иметь состав от Bi2O2,8 до Bi2O3,11. Конгруэнтной сублимации при этой температуре отвечает состав Bi2O2,92±0,04.
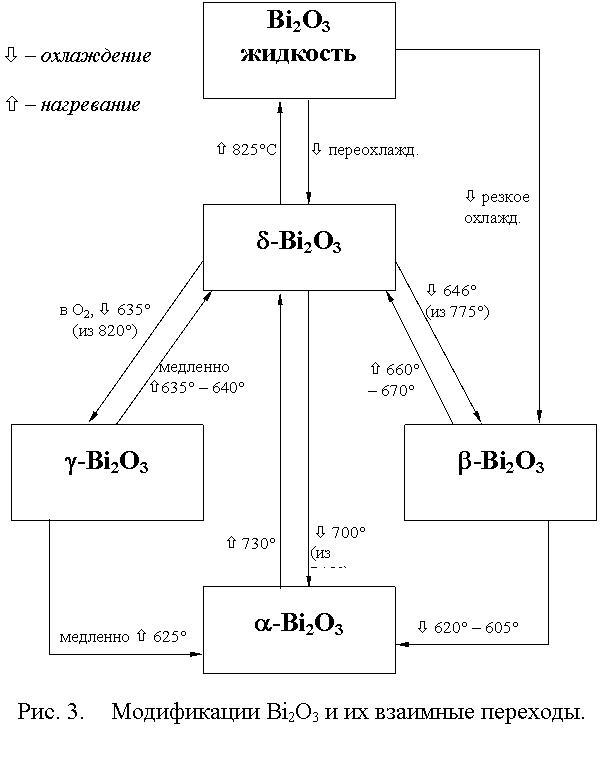 3.2 Свойства.
3.2 Свойства.
d-Bi2O3 плавится при 825°С [12]. Для температуры кипения в [9] приводится значение 1890°С.
DfH°298 (a-Bi2O3) = – 577 кДж/моль [9].
Оксид висмута (III) нерастворим в воде и растворах щелочей. Кислотами переводится в соли висмута (III):
Bi2O3 (тв) + 6HCl (р) = 2BiCl3 (p) + 3H2O.
b-, g- и d-модификации оксида висмута являются анионными проводниками с незначительным вкладом электронной проводимости, тогда как a-Bi2O3 – полупроводник [11].
3.3 Получение.
Наилучшим способом получения оксида висмута считается взаимодействие растворов солей висмута (III), например нитрата Bi(NO3)3 или сульфата Bi2(SO4)3, с избытком раствора щелочи:
Bi(NO3)3 + 3NaOH = Bi(OH)3¯ +3NaNO3.
В осадок выпадает гидроксид висмута, который затем обезвоживают прокаливанием:
2Bi(OH)3![]() Bi2O3 + 3H2O.
Bi2O3 + 3H2O.
4. Фторид висмута (III).
4.1 Строение.
Трифторид висмута существует в виде двух полиморфных модификаций. Устойчивой при стандартных условиях является ромбическая модификация R-BiF3, при давлении 15±3 кбар переходящая в тисонитоподобную (Т-BiF3). При атмосферном давлении Т-BiF3 неустойчив и при отжиге легко переходит в R-BiF3 [16].
Параметры элементарной ячейки для первой из модификаций (по [15]): а = 6,565(7) Å, b = 7,016(7) Å, c = 4,841(5) Å. R-BiF3 изоструктурен фториду иттрия (пр. гр. Pnma, Z = 4).
Атом Bi в R-BiF3 окружен восемью ближайшими атомами фтора на расстояниях 2,217 – 2,502 Г, девятый атом фтора находится на расстоянии 3,100 Г (рис. 3). Такое искажение координационной сферы атома висмута объясняется наличием стереохимически активной пары электронов на атоме висмута.
Рис. 4. Окружение атома Bi в R-BiF3.
4.2 Свойства.
Фторид висмута на воздухе малоустойчив. Уже при комнатной температуре во влажном воздухе он начинает гидролизоваться, а при повышенных температурах пирогидролиз идет до конца по схеме:
BiF3 + H2O![]() BiOyF3-2y
BiOyF3-2y![]() BiOF
BiOF![]() Bi2O3
Bi2O3
Поэтому препараты фторида висмута следует хранить без доступа влаги – в эксикаторе над Р2О5.
Температура плавления (в токе HF) составляет 757°С [16]. Температура кипения – 900°С [9].
DfH°298 (BiF3) = - 899 кДж/моль [9].
4.3 Получение.
Основные способы получения чистого трифторида висмута сводятся к взаимодействию Bi2O3 или Bi(OH)3 с сильными фторирующими агентами, в качестве которых были предложены SF4, BrF3 [15] и др.
В работе [17] было предложено обрабатывать оксид или гидроксид висмута концентрированной плавиковой кислотой в платиновой чашке при нагревании. Получающийся гидрат трифторида висмута затем дегидратируют в платиновых тиглях в токе сухого фтороводорода при 300°С.
В той же работе [17] приведена еще одна методика. Трибромид висмута, получаемый прямым взаимодействием элементов, обрабатывают фторидом аммония в метанольном растворе по реакции:
BiBr3 + 4NH4F = NH4BiF4 + 3NH4Br.
Выпавший осадок тетрафторвисмутата (III) аммония отделяют, промывают эфиром и сушат при 60°С. Прокаливая его при 300°С можно получить безводный BiF3:
NH4BiF4 ![]() BiF3 + NH3 + HF.
BiF3 + NH3 + HF.
5. Система BiF3-Bi2O3.
Наиболее подробно данная система изучалась в [15,18]. Построена фазовая диаграмма (рис. 5). В области, богатой фторидом висмута образуется твердый раствор a со структурой тисонита LaF3 с содержанием оксида 0,7 – 3,45 моль. % (0,02£y£0,1 в формуле BiOyF3-2y). По мере увеличения доли Bi2O3 параметры гексагональной ячейки изменяются следующим образом: а уменьшается от 7,076(7) Å до 7,053(7) Å, а "с" увеличивается от 7,313(7) Å до 7,338(7) Å. При содержании оксида 3,45 – 6 моль. % образуется ряд упорядоченных фаз со структурой, производной от тисонита. Индицирование их рентгенограмм затруднено вследствие близости их строения. На диаграмме (рис. 5) для легкости восприятия вся область составов 0,7 – 6 % Bi2O3 изображена как твердый раствор a [15].
В области содержания оксида 20 – 33 мольных % образуется ряд упорядоченных фаз со структурой, производной от флюорита. В работе [15] перечислены их составы: 20; 21; 22,5; 25 и 33 моль. % Bi2O3 и рассчитаны параметры элементарных ячеек, приведенные в таб. 1. В работе [19] уточнен состав последней из них – Bi7F11O5 (31,25 моль. % Bi2O3). Эта фаза построена из упорядоченных колончатых кластеров [19]. При температурах 290 – 410°С все фазы претерпевают полиморфный переход (происходит разупорядочение), образуя анионизбыточный флюоритовый твердый раствор, т.н. b-фазу. Закалить ее, то есть получить при комнатной температуре авторам [15] не удалось. b-фаза – самое тугоплавкое соединение в системе: максимальная температура плавления составляет 995°С [15].
При эквимолярном соотношении Bi2O3 и BiF3 образуется стехиометрический оксофторид BiOF, изоструктурный PbFCl. Соединение кристаллизуется в тетрагональной сингонии с параметрами элементарной ячейки а = 3,750(5) Å, с = 6,228(9) Å. Авторы [15] предполагают наличие полиморфного перехода BiOF в кубическую флюоритоподобную модификацию при 620°С.
Таб. 1. Рентгенографические характеристики оксофторидных фаз висмута со структурой, производной от флюорита.
| Доля Bi2O3, |
Сингония | Параметры | |||
| моль. % | a, Å | b, Å | c, Å | b, ° | |
| 20* | моноклинная | 4,09(1) | 5,89(1) | 4,13(1) | 90,3(1) |
| 21* | ромбическая | 4,14(1) | 4,16(1) | 5,88(1) | — |
| 22,5* | тетрагональная | 4,14(1) | — | 5,82(1) | — |
| 25* | ромбическая | 4,12(1) | 4,10(1) | 5,83(1) | — |
| 33* | ромбическая | 5,760(9) | 5,569(8) | 6,120(9) | — |
| 31,25** | моноклинная | 13,5238(3) | 5,5285(1) | 9,1886(2) | 96,171(1) |
