Методы измерения ионных токов
получаемые при регистрации на хромафинных
клетках в конфигурации РЦК
|
Последовательное сопротивление, Rs |
4 МОм |
|
Ёмкость клетки, C |
5 пФ |
|
Пост. Времени фиксации потенциала, RsC |
20 мкс |
|
Пост. Времени обмена ионов, tоб |
5с |
|
Сопротивление клетки, R |
10ГОм |
|
Сопротивление утечки, Rут |
20ГОм |
|
Шум (среднеквадр. значение, 0-400 Гц) |
0,15 пА |
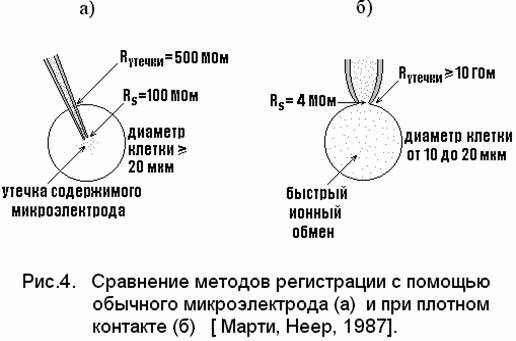
Данные таблицы отличаются от значений, полученных с обычными стеклянными микроэлектродами по трем основным пунктам:
1. большинство клеток с диаметром менее 20 мкм при прокалывании обычным микроэлектродом повреждается, в то время как РЦК можно проводить даже на клетках диаметром менее 10 мкм, совершенно не нарушая их.
2. Сопротивление утечки микроэлектрод-клетка при использовании обычных микроэлектродов не превышает 500 МОм, в то время как соответствующее значение сопротивления утечки при РЦК могут быть 20 ГОм и более.
3.
 |
Метод РЦК применяется для регистрации токов в мембране опухолевых клеток гипофиза, внутренних сегментов палочек сетчатки, островковых клеток поджелудочной железы, клеток миокарда, наружных сегментов палочек сетчатки, нейронов спинного мозга млекопитающих и др.
Пэтч-кламп регистрация при неплотном контакте
Метод регистрации от целой клетки в условиях плотного контакта позволяет регистрировать ионные токи, протекающие через небольшие мембранные фрагменты, которые содержат только один или несколько ионных каналов. Для получения информации о кинетике работы каналов или о плотности токов через мембрану проводится одновременная регистрация работы множественных каналов с использованием метода пэтч-кламп или применяется классический метод фиксации мембранного потенциала.
Регистрация при неплотном контакте по сути идентична регистрации одиночных каналов, за исключением того, что участок мембраны, на котором фиксируется потенциал, на 3 порядка больше, и при этом не требуется формирования гигаомных контактов.
Метод позволяет без труда получать стабильные электрофизиологические данные от локальных участков мембраны, используя интактные клетки практически без их изоляции или других видов обработки. Например, можно проводить измерения на целой мышце, не выделяя одиночные клетки. Отпадает необходимость и в использовании внутриклеточных микроэлектродов.
Однако, необходимо отметить, что наиболее корректную информацию о мембранной проводимости всё-таки даёт регистрация токов через одиночные каналы, так как позволяет избавиться от ряда артефактов, которые могут быть получены при регистрации макроскопического тока. Имеются, по крайней мере, четыре основные проблемы, с которыми приходится сталкиваться при регистрации макроскопических токов. Во-первых, трудно создать условия для регистрации тока только через каналы интересующего нас типа. Во-вторых, влияние последовательного сопротивления
может приводить к различию между истинным мембранным и поддерживаемым потенциалом. В-третьих, накопление ионов в примембранной области может вызывать зависящее от времени изменение тока через отдельные каналы. И, наконец, потенциал-зависимость проводимости открытого канала может быть ошибочно принята за потенциал-зависимость активации канала.
Литература:
- Медведев С.С. Электрофизиология растений. – СПб.: Изд-во
С-Петебург. ун-та, 1998. – 184 с.
- Регистрация одиночных каналов / под ред. Сакмана Б. и
Неера Э. – М.: “Мир”, 1991
- Эккерт Р., Рэнделл.Д, Огастин Дж. – Физиология животных,
механизмы и адаптация. – М.: “Мир”,1991
- Hedrich R., Schroeder.J.I. and Fernandez J.M. – Patch-clamp studies on higher plant cells: a perspective. // Trends biochemistry science. – 1987. – v.12. pp. 49-52&
