Платина и рак - биохимия, физиология, медицина
Основной путь выведения платины из организма – почки и желудочно-кишечный тракт (при пероральном приеме). При однократном введении в желудок общая задержка в организме составляет 0.4%.[5] Некоторые соединения (например, кофеин) способны усиливать токсическое действие соединений платины.
Все сказанное полностью относится и к описанным ниже препаратам. Более того, именно токсичность является лимитирующим фактором в терапии всеми платиносодержащими соединениями. Одним из основных направлений в исследованиях противоопухолевых препаратов сегодня является разработка нетоксичных аналогов цисплатина (который, кстати, при введении мышам помимо лекарственного эффекта вызывает все описанные симптомы вплоть до конвульсий и летального исхода). Некоторые соединения, при совместном с цисплатином введении, существенно снижают токсичность последнего, например, маннит в сочетании с большим потреблением воды вызывает обильный диурез и снижает токсическую нагрузку на почки. В этом направлении также ведутся работы3.
В целом, хотя “благородная” платина уже более века служит химикам-неорганикам, исследующим координационные соединения, ее ядовитый характер требует серьезного и осторожного к себе отношения.
ХИМИЯ ПЛАТИНОВЫХ ПРЕПАРАТОВ
Для платины в физиологических условиях наиболее стабильными являются степени окисления 0, 2+ и 4+. Первая соответствует металлической платине и некоторым нестабильным и крайне ядовитым соединениям. Лекарственного применения платина в этой степени окисления не находит.* Состояния 2+ и 4+ характеризуются:
a) строго определенным расположением лигандов в координационной сфере комплекса. Для Pt(II) это в большинстве случаев квадрат, для Pt(IV) – октаэдр с четырьмя и шестью положениями соответственно.
b) наличием так называемого “эффекта трансвлияния”, когда химическая подвижность лиганда в координационной сфере определяется природой его соседа напротив (в транс-положении). На этом явлении основаны все методики синтезов в современной координационной химии платиновых металлов.
c) кинетической заторможенностью реакций – при комнатной температуре на количественное замещение одного лиганда другим требуется не менее суток.
d) отсутствием (или медленностью) внутрисферных изомеризаций. Никогда при комнатной температуре переход, к примеру, цис-транс, не длится менее нескольких дней, даже в растворе.
e) “хорошей“ геометрией – некоторые параметры структуры комплексов допускают взаимодействие с ДНК с образованием прочных координационных (Pt-N) и водородных (N-H-O) связей.
Приведенная совокупность свойств уникальна и характерна только для элемента №78. Ни его соседи, ни иные элементы Периодической Системы этим или схожим набором характеристик не обладают.
Обратимся теперь непосредственно к платиновым препаратам. Сразу после обнаружения противоопухолевого эффекта цисплатина, многие лаборатории по всему миру предприняли исследования его структурных аналогов. К сожалению, очень немногие из найденных лекарств по терапевтическому индексу (отношение активность/токсичность) превзошли цисплатин. Одно из самых удачных синтезированных к настоящему времени соединений – карбоплатин – выигрывает за счет меньшей токсичности. Наиболее важные и используемые в клинической практике соединения и их латинские названия приведены на схеме в Приложении 1.
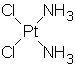 Цисплатин, противоопухолевую активность которого обнаружил Розенберг, в своей структуре содержит сразу все параметры, которые, как сейчас полагают, являются необходимыми для цитостатического действия:
Цисплатин, противоопухолевую активность которого обнаружил Розенберг, в своей структуре содержит сразу все параметры, которые, как сейчас полагают, являются необходимыми для цитостатического действия:
a) Необходимо присутствие двух амминных лигандов (или одного бидентатного) в цис-конфигурации. В бидентатном случае последнее требование обычно выполнено автоматически. Соединения должны удовлетворять формуле цис-Pt2+X2Am2 или цис-Pt4+Y2X2Am2, где X,Y- подвижные (важно!) моно- или бидентатные лиганды. В большинстве случаев X=Cl, -OOC-R; Y=H2O, Cl, -OOC-R.
b) Амминные лиганды должны содержать по меньшей мере один протон при атоме азота. Все протестированные комплексы с третичными аминами оказались неактивными. Немалой роли атомов водорода при азоте платиновых комплексов посвящен обзор Ридиджка.[6]
Для выяснения биохимических причин таких требований к структуре комплекса различными авторами были предприняты исследования взаимодействий цисплатина (как наиболее доступного и эффективного препарата) с различными биомолекулами in vitro. Обнаружилось следующее:
· Взаимодействие цисплатина с биомолекулами, содержащими тиольный атом серы приводит к необратимой инактивации препарата в результате образования прочного комплекса с серой. К “опасным” в этом отношении соединениям относятся аминокислоты цистеин и метионин, глутатион цитоплазмы и вездесущие в организме белки.
· В дистиллированной воде цисплатин гидролизуется с образованием сложных (µ-гидроксо)полимерных молекул, при этом ион хлора заменяется на ОН. Однако, концентрация хлорида в физрастворе достаточна для подавления гидролиза и в крови его не происходит.*
·  С нуклеотидными основаниями ДДП (дихлородиамминплатина, синоним цисплатина) образует продукты вытеснения обоих атомов хлора из координационной сферы Pt. С пуриновыми нуклеотидами атом платины связывается не через экзоциклическую аминогруппу, как можно было бы предположить, а через гетероциклический атом азота N7, образуя комплексы состава цис-Pt(NH3)2(Guanine-N7)2 и цис-Pt(NH3)2(Guanine-N7)(Adenine-N7). Резкое преобладание первых (выявленное в конкурентных реакциях) объясняется образованием дополнительной водородной связи между протоном аминогруппы и экзоциклическим C6-кислородом гуанина. С цитозином связывание происходит через N3, с тимином и урацилом в нейтральном растворе оно слабо. Ряд “предпочтений” можно построить следующим образом: Guanine-N7 >> Adenine-N7 > Adenine-N1 > Cytidine-N3 >> Thymine & Uracil. Наличие фосфатной группы в 5´-положении фуранозного цикла ускоряет реакцию из-за образования водородных связей между кислородом фосфата и протонами амминных лигандов.
С нуклеотидными основаниями ДДП (дихлородиамминплатина, синоним цисплатина) образует продукты вытеснения обоих атомов хлора из координационной сферы Pt. С пуриновыми нуклеотидами атом платины связывается не через экзоциклическую аминогруппу, как можно было бы предположить, а через гетероциклический атом азота N7, образуя комплексы состава цис-Pt(NH3)2(Guanine-N7)2 и цис-Pt(NH3)2(Guanine-N7)(Adenine-N7). Резкое преобладание первых (выявленное в конкурентных реакциях) объясняется образованием дополнительной водородной связи между протоном аминогруппы и экзоциклическим C6-кислородом гуанина. С цитозином связывание происходит через N3, с тимином и урацилом в нейтральном растворе оно слабо. Ряд “предпочтений” можно построить следующим образом: Guanine-N7 >> Adenine-N7 > Adenine-N1 > Cytidine-N3 >> Thymine & Uracil. Наличие фосфатной группы в 5´-положении фуранозного цикла ускоряет реакцию из-за образования водородных связей между кислородом фосфата и протонами амминных лигандов.

· Взаимодействие цисплатина с одноцепочечными ДНК приводит к образованию локальных группировок GG-DDP, GXG-DDP, GA-DDP, в порядке уменьшения сродства. Цисплатин, таким образом, “сшивает” соседние основания одной цепи ДНК, причем структуры гуанин-ДДП-гуанин образуются даже “через один” (любой, кроме А) нуклеотид (обозначен Х).
· В двухцепочечной ДНК цисплатин образует аналогичные уже описанным сшивки. Рентгеноструктурные исследования показали, что форма двойной спирали при этом практически не искажается (!).6
· Цис- и транс-дихлородиамминплатина во взаимодействиях с ДНК отличаются только количеством образуемых водородных связей. Второе вещество, в отличие от первого, никакой противораковой активности не обнаруживает.*
