Платина и рак - биохимия, физиология, медицина
Дальнейшие исследования убедительно показали, что основная причина цитостатической активности цисплатина – нарушение репликации ДНК в результате образования внутрицепочечных (intrastrand) платиновых сшивок. С начала прошлого века известны и другие соединения, взывающие появление в ДНК продольных и поперечных связей. Это препараты группы иприта** (горчичного газа, mustard gas в английской транскрипции). Так называемые “горчицы” (mustards), состава Cl-CH2-CH2-S-R (sulfur mustard) и (Cl-CH2-CH2)2-NR (nitrogen mustard) широко применяются в биохимии именно для этой цели. Сравнительная характеристика воздействия на ДНК “горчиц” и цисплатина приведена в обзоре Робертса3. В свое время на основании именно этих данных был сделан вывод о том, что цисплатин при взаимодействии с ДНК работает как бифункциональный агент.
МОЛЕКУЛЯРНО-БИОЛОГИЧЕСКИЕ “ТЕРРОРИСТЫ”
Оставим с в стороне вопрос о том, как ДДП попадает в клетку – к настоящему моменту в этом направлении высказаны лишь некоторые предположения той или иной степени правдоподобия.
Будучи внутрикомплексным незаряженным соединением, цисплатин и его аналоги теоретически способны диффундировать сквозь мембрану пассивно. В пользу такого предположения говорит корреляция активности препарата и его растворимости в слабополярном растворителе (хлороформ). Коэффициент экстракции вещества хлороформом некоторое время даже использовали в качестве предварительного теста на “перспективность” того или иного соединения. С обнаружением исключений такие тесты были прекращены.
Предположение о том, что ДДП проникает в клетку активным путем (обманув какую-то транспортную систему) пока не получило решающих аргументов ни за, ни против. Точно известно одно – в клетки попадает далеко не весь введенный препарат. Бóльшая его часть выводится из кровяного русла* почками, главным образом в неизменном виде или в виде тетрамминных комплексов. Именно поэтому главным “пострадавшим” от побочных эффектов платиновых лекарств оказывается система выделения. Усиленной гидратацией организма, введением стимуляторов диуреза и подбором расписания приема препарата почечную токсичность можно свести к минимуму.
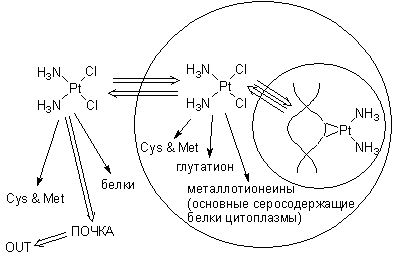
Проникнув так или иначе в клетку, цисплатин и его аналоги начинают вносить глубокие искажения в работу ферментативных систем. Уже упомянутое сродство иона платины к сульфидной сере приводит к следующему: повстречав серосодержащий фермент** и присоединившись к SH-группе, цисплатин в лучшем (и редком) случае ингибирует его, а в худшем (и как правило) -- необратимо портит. Учтя отношение молекулярных масс ДДП и ферментов, можно увидеть, что для нарушения работы многих ферментных систем достаточно пикограммовых количеств платиновых препаратов. Некоторые ферменты в клетке присутствуют в количестве всего нескольких десятков молекул.*
Вопрос о том, попадает ли ДДП в ядро путем пассивной диффузии или обманывая внутриклеточную систему транспорта, остается невыясненным. В экспериментах на природной двухцепочечной ДНК in vitro показано, что в присутствие в растворе одновременно ДНК и белков, препараты платины связываются главным образом с ДНК. Это странный факт, т.к. сера (сульфидная, или тиомочевина) вытесняет мономерные нуклеотиды из координационной сферы платины. Привлечение “стерических факторов” и хелатного эффекта не дает безупречного объяснения.
В опытах in vitro показано, что репликация “платинированной” ДНК происходит с грубыми ошибками, похожими на те, что возникают при репликации ДНК с тимидиновыми димерами и апуриновыми сайтами в клетках с генетически отключенными системами ремонта (опыты на E.coli)3. На кишечной палочке показано также большое функциональное сходство платинированной ДНК с ДНК, полученной при рентгеновском или радиоактивном облучении клетки. Этот радиомиметический (radiomimetic) эффект позволяет использовать ДДП в качестве сенсибилизатора опухолей при радиотерапии.
В норме тимидиновыми димерами и иными повреждениями, возникающими при облучении или химическом воздействии** на ДНК, заведуют клеточные системы специфической, эксцизионной и пострепликативной репарации. Наиболее эффективна вторая, суть ее работы вкратце заключается в “вырезании” поврежденного участка нуклеазами и последующем досинтезе нормальной цепи по сохранившейся комплиментарной. Пострепликативная репарация включается при обнаружении дефектов рекомбинации вновь синтезированной цепи. В опытах на E.сoli показано, что клетка, дефектная по генам ключевых компонент тех или иных репарационных систем, намного более чувствительна к воздействию ДДП, чем здоровая. Это дает некоторое объяснение селективному действию платиновых препаратов на ряд (вполне конкретных) видов опухолей. В раковой клетке часть репарационных систем может не функционировать. Впрочем, возможен и обратный вариант – искусственный отбор, вызванный привнесенным токсином, приводит к выделению из популяции и размножению мутантов, в которых системы репарации чрезвычайно активны. Показано, что длительное выращивание клеток на платиносодержащей среде вызывает появление у них устойчивости к повышенным дозам цисплатина. У некоторых клеток (наиболее “проблемных” в настоящее время опухолей) эта устойчивость имеется изначально. Данный факт создает трудности в химиотерапии, так как встречаются пациенты с врожденной устойчивостью к препаратам платины (platinum-resistant patients). У некоторых устойчивость появляется в процессе терапии. В таких случаях лекарственный эффект пропадает, токсичность же остается на прежнем уровне.
Нормальная концентрация исправимых дефектов в клеточной ДНК – один-два на несколько десятков тысяч нуклеотидов. При платинировании ДНК in vitro было без труда получено несколько платиновых сшивок на 20-30 bp. Даже на порядок более низкая концентрация дефектов клеточным системам репарации оказывается не под силу. Репликация ДНК происходит с не исправляемыми ошибками, тут же и дочерние молекулы “нагружаются” платиной, и, наконец, после одного или нескольких делений, клетка гибнет.
Условие “после одного или нескольких делений” имеет критическую важность. Известно, что клетки раковой опухоли делятся намного чаще, чем клетки большинства тканей организма. Это позволяет платиновому препарату оказать селективное воздействие именно на опухоль, не повреждая ткани организма.
Описанный выше механизм уничтожения клеток действием препаратов платины очень эффективен. Но, к сожалению очень часто жертва платинового комплекса к раковой опухоли не имеет никакого отношения. Как правило, вместе с опухолью при терапии цисплатином и аналогами повреждаются все быстро растущие или обновляющиеся ткани организма – слизистые оболочки желудочно-кишечного тракта, дыхательной системы, глаз, эпителий кожи и роговицы, кровь, ткани прилегающие к ранам и т.д. Их клетки, получая то же количество платины (ее проникновение в клетки не селективно) и столь же быстро делясь, страдают от терапии так же, как и опухоль. Результатом, помимо “косметических” повреждений кожи и выпадения волос, может быть приобретенный иммунодефицит, изъязвления желудочно-кишечного тракта и ротовой полости, трудности с заживлением ран. На все это накладываются острые токсические эффекты, описанные выше.[7]
