Активность. Порядок реакций
1. Активность
Рассмотренные нами соотношения для идеальных растворов не могут быть непосредственно использованы для вычисления равновесия, в котором участвуют реальные растворы, в частности в реальных растворах не выполняется один из основных законов химии – з. действия масс. При подставлении в выражения для константы равновесия концентрации реагирующих веществ константа равновесия оказывается не постоянно зависящей от концентрации. В случае идеальных растворов из измерения одного из свойств (давление пара) можно рассчитать все другие свойства. Желательно сохранить такую возможность для реальных растворов. Решение было предложено Льюисом, который ввел в теорию растворов так называемые т/д активности в качаестве ф-ии, связывающей свойства равствора друг с другом и заменил концентрацию в реальных растворах. Подставляя т/д активность в место концентрации, в т/д уравнение, полученное для идеальных растворов делает последнее пригодным и для реальных растворов. Т.о. активностью называется величина, подставляя которую вместо концентрации в т/д уравнение делает последнее применимым для реальных растворов, а – активность. После введения активного хим. потенциала i определяется соотношением ![]() Bb+dD↔Mm+rR. Константу равновесия определяет соотношение
Bb+dD↔Mm+rR. Константу равновесия определяет соотношение ![]() . З. распределения, если раствор 3-го вещества нельзя считать идеальным
. З. распределения, если раствор 3-го вещества нельзя считать идеальным ![]() . Активность должна быть введена таким образом чтобы в идеальных растворах она совпадала с концентрацией, а в реальных растворах она должна характеризовать отклонение их от идеальных. По Льюису активность выражается соотношением давление пара данного компонента над реальным раствором к давлению пара этого компонента в некотором стандартном состоянии
. Активность должна быть введена таким образом чтобы в идеальных растворах она совпадала с концентрацией, а в реальных растворах она должна характеризовать отклонение их от идеальных. По Льюису активность выражается соотношением давление пара данного компонента над реальным раствором к давлению пара этого компонента в некотором стандартном состоянии ![]() . Для растворимости в водных растворах для всех компонентов летучих жидких смесей. В начале стандартного состояния берут состояние компонентов в чистом виде и тогда при данной температуре
. Для растворимости в водных растворах для всех компонентов летучих жидких смесей. В начале стандартного состояния берут состояние компонентов в чистом виде и тогда при данной температуре ![]()
![]() . В совершенном растворе соотношение
. В совершенном растворе соотношение ![]() => в идеальном растворе активность = концентрации
=> в идеальном растворе активность = концентрации ![]() , в реальном растворе
, в реальном растворе ![]() . Степень отклонения активности и концентрации определяется величиной коэффициента активности
. Степень отклонения активности и концентрации определяется величиной коэффициента активности ![]() . В идеальном растворе
. В идеальном растворе ![]() , в реальном растворе может быть > и < 1. В разбавленных растворах для растворителя выполняется закона Рауля, а для растворов вещества з. Генри
, в реальном растворе может быть > и < 1. В разбавленных растворах для растворителя выполняется закона Рауля, а для растворов вещества з. Генри ![]() . Для растворённого вещества стандартное состояние должно быть сделано таким образом, чтобы в растворе любой концентрации соблюдался закон Генри
. Для растворённого вещества стандартное состояние должно быть сделано таким образом, чтобы в растворе любой концентрации соблюдался закон Генри ![]() ,
, ![]()
![]() .
.
Связи м/у активностями компонентов
Уравнение Дюгема-Маргулиса:
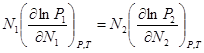 (1). Если раствор является близким к совершенному, то
(1). Если раствор является близким к совершенному, то ![]() , а
, а ![]() .
. ![]() ,
, ![]() . Продифиринцируем (
. Продифиринцируем (![]() и
и ![]() =const)
=const) 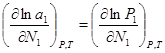 (2),
(2), 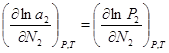 (3). Подставим
(3). Подставим 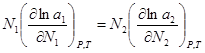 (4). Уравнение (4) может быть обобщено на раствор, содержащий несколько компонентов:
(4). Уравнение (4) может быть обобщено на раствор, содержащий несколько компонентов: 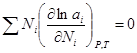 . Если раствор близок к разбавленному
. Если раствор близок к разбавленному ![]() для растворённого вещ-ва
для растворённого вещ-ва ![]() . Повторяя действие, что и здесь справедливо уравнение (4). Для бинарного раствора уравнение (4) имеет вид:
. Повторяя действие, что и здесь справедливо уравнение (4). Для бинарного раствора уравнение (4) имеет вид: ![]() ,
, 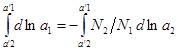 ,
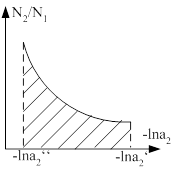
, 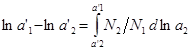 . Если известна зависимость активности второго компонента от концентрации, а так же активность первого компонента для какой либо концентрации, то можно активность компонента для другой концентрации. Зная
. Если известна зависимость активности второго компонента от концентрации, а так же активность первого компонента для какой либо концентрации, то можно активность компонента для другой концентрации. Зная ![]() , можно подсчитать
, можно подсчитать ![]() .
.
Методы определения активности
1) Определение активности по давлению пара, если компонент летучий; например, раствор олово-цинк близок к совершенному. Давление пара при 957К ![]() , а давление пара над сплавом олово-цинк, в котором молярная доля цинка 0,226, составляет
, а давление пара над сплавом олово-цинк, в котором молярная доля цинка 0,226, составляет ![]() . По определению,
. По определению, ![]() , а для летучего компонента
, а для летучего компонента ![]() . Коэффициент активности
. Коэффициент активности ![]()
2) Определение активности на основе закона распределения. В реальных растворах коэффициент распределения рассчитывается по формуле: ![]() , где
, где ![]() и
и ![]() - активности распределяющегося вещества 1-ой и 2-ой фазы. При бесконечном разбавлении, когда количество введенного 3-го компонента невелико, активности равны соответствующим концентрациям, определяя которые, вычисляют к.
- активности распределяющегося вещества 1-ой и 2-ой фазы. При бесконечном разбавлении, когда количество введенного 3-го компонента невелико, активности равны соответствующим концентрациям, определяя которые, вычисляют к. ![]() . Если константа распределения велика, то при увеличении общего количества введенного 3-го компонента 2-й раствор может оставаться идеальным вплоть до насыщения и тогда закон распределения может быть представлен в виде:
. Если константа распределения велика, то при увеличении общего количества введенного 3-го компонента 2-й раствор может оставаться идеальным вплоть до насыщения и тогда закон распределения может быть представлен в виде: ![]() . Определяя С2 и зная константу, рассчитывают а1 , а1=КС2 – активность 3-го компонента в 1-ом растворе.
. Определяя С2 и зная константу, рассчитывают а1 , а1=КС2 – активность 3-го компонента в 1-ом растворе.
