Активность. Порядок реакций
Существуют и другие методы определения активности, например, криоскопические. Активность определяется по измеренному понижению температуры замерзания раствора по сравнению с чистым растворителем: ![]() . Активность можно определить из изучения химического равновесия, вычисляя Кр.
. Активность можно определить из изучения химического равновесия, вычисляя Кр.
3) Активность можно вычислить из электрохимических измерений. Например, по формуле Нернста для металлического электрода в растворе своей соли: ![]() , где:
, где: ![]() - стандартный электродный потенциал;
- стандартный электродный потенциал; ![]() - потенциал электронов в растворе, измеряемый существующими методами. Зная
- потенциал электронов в растворе, измеряемый существующими методами. Зная ![]() и
и ![]() рассчитываем а.
рассчитываем а.
Необратимые реакции
Для реакции первого порядка ![]() , где С – концентрация реагирующего исходного вещества. С другой стороны,
, где С – концентрация реагирующего исходного вещества. С другой стороны, ![]() .
.
![]() ;
;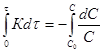 ;
;![]() ;
;![]() (2)
(2)
Из (2) следует, что константа скорости реакции первого порядка не зависит от способа выражения концентрации и имеет размерность ![]() :
:
![]() (3)
(3)
Из уравнения (3) следует, что график в координатах ![]() будет прямой линией:
будет прямой линией:

Уравнение (2) часто записывают в виде ![]() . Для характеристики скорости реакции часто пользуются величиной, называемой временем полупревращения (периодом полураспада), обозначаемой
. Для характеристики скорости реакции часто пользуются величиной, называемой временем полупревращения (периодом полураспада), обозначаемой ![]() - это время, в течение которого испытывает превращение половина взятого исходного вещества. Найдем выражение для
- это время, в течение которого испытывает превращение половина взятого исходного вещества. Найдем выражение для ![]() .
.
В выражение (2) подставляем ![]() :
: 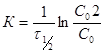 ,
, ![]()
Для реакции 1-го порядка время полупревращения не зависит от начальной концентрации.
Часто в кинетические уравнения подобного вида вводят величину Х, которая характеризует количество вещества, вступившего в реакцию, тогда ![]() и
и ![]() .
.
![]() ;
; 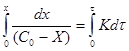
![]()
![]()
Все превращения радиоактивных веществ протекают по первому порядку. Уравнениями первого порядка описываются некоторые другие физические процессы, например, самопроизвольное излучение электронов невозбужденных атомов и молекул. По первому порядку протекает реакция ацетона:
![]()
Необратимые реакции второго порядка
![]()
![]() ;
; ![]() ;
;![]() ;
;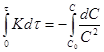 ;
;![]() (1)
(1)
![]() (2)
(2) ![]() (3)
(3)
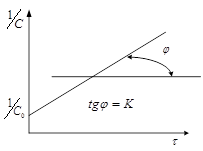
Из (3) следует, что в координатах ![]() график будет прямой линией.
график будет прямой линией.
![]()
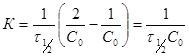
![]() ,
,
т.е. время полупревращения для реакции 2-го порядка обратно пропорционально начальной концентрации.
Рассмотрим более сложный случай: ![]()
Пусть Х – количество вещества А, вступившего в реакцию ко времени τ.
![]()
![]()
![]()
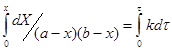
![]()
![]()
Реакциями 2-го порядка являются, например, реакции образования и разложения HI.
![]() ;
;
Омыление этилацетата щелочью и т.д.
Необратимые реакции третьего порядка
Такие реакции встречаются. В газовой фазе изучены пять таких реакций: взаимодействие оксида азота (II) с водородом, кислородом, хлором, бромом, йодом. Например: ![]() . В растворах известно большее количество таких реакций – окислительно-восстановительного характера. Рассмотрим простой случай, для которого
. В растворах известно большее количество таких реакций – окислительно-восстановительного характера. Рассмотрим простой случай, для которого ![]() и
и ![]() , где С – концентрация исходного вещества.
, где С – концентрация исходного вещества.
![]() ;
;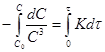 ;
;![]() (1)
(1) 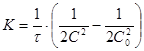 (2)
(2)
Следовательно, константа скорости реакции третьего порядка имеет размерность ![]() . В зависимости от способа выражения концентрации выражение (1) можно переписать в виде:
. В зависимости от способа выражения концентрации выражение (1) можно переписать в виде: ![]() , следовательно, в координатах
, следовательно, в координатах ![]() мы будем иметь прямую линию:
мы будем иметь прямую линию:
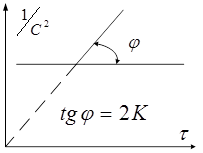
Это используют для графического определения константы скорости.
