Активность. Порядок реакций
Выражение дл времени полупревращения найдем подстановкой в уравнение (2) ![]() :
: ![]() , т.е. время полупревращения обратно пропорционально квадрату начальной скорости.
, т.е. время полупревращения обратно пропорционально квадрату начальной скорости.
Р-ии дробного, нулевого
Для необратимой р-ии n–ого порядка для которой W=KCn. Для р-ии 2-го и 3-го порядка можно записать: ![]() (1).
(1).
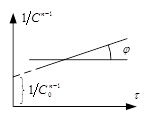
Выражения для времени полупревращения записывается ![]() (2). Уравнение 1 можно записать в виде
(2). Уравнение 1 можно записать в виде ![]() =>
=> ![]()
![]() . Дробный порядок р-ии указывает обычно на одновременное протекание нескольких этапов р-ии мало отличающихся друг от друга по скоростям ил на протекание обратимой р-ии. Часто дробный порядок имеют р-ии с участием атомов: CO+Cl2→COCl2.
. Дробный порядок р-ии указывает обычно на одновременное протекание нескольких этапов р-ии мало отличающихся друг от друга по скоростям ил на протекание обратимой р-ии. Часто дробный порядок имеют р-ии с участием атомов: CO+Cl2→COCl2. ![]()
![]() Нулевой порядок р-ии имеет место при постоянной скорости р-ии, что возможно при поддержании постоянной концентрации исходных веществ. Нулевой порядок встречается среди гетерогенных р-ий. Если х - количество вещества вступившего в р-ию, то
Нулевой порядок р-ии имеет место при постоянной скорости р-ии, что возможно при поддержании постоянной концентрации исходных веществ. Нулевой порядок встречается среди гетерогенных р-ий. Если х - количество вещества вступившего в р-ию, то ![]() ,
, ![]() ,
, 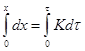 ,
, ![]()
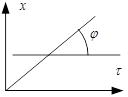
![]() .
.
Методы определения порядка хим р-ии
Методы делятся на дифференциальные и интегральные. Дифференциальные используют исходное диф. ур ![]() . Интегральные методы используют уравнения после интегрирования. Среди интегральных методов используются: 1) подстановки 2) графический 3) определение по времени полупревращения. 1) получение опытным путём данных по зависимости концентрации реагир. вещества от времени подстановки в ур. для константы скорости р-ии различного порядка. Порядок р-ии определяется уравнением-подстановкой, в которое экспериментальных данных даёт постоянное значение константы скорости р-ии 2) экспериментальные данные представляются в виде графиков. Если в координатах
. Интегральные методы используют уравнения после интегрирования. Среди интегральных методов используются: 1) подстановки 2) графический 3) определение по времени полупревращения. 1) получение опытным путём данных по зависимости концентрации реагир. вещества от времени подстановки в ур. для константы скорости р-ии различного порядка. Порядок р-ии определяется уравнением-подстановкой, в которое экспериментальных данных даёт постоянное значение константы скорости р-ии 2) экспериментальные данные представляются в виде графиков. Если в координатах ![]() получится прямая линия, то р-ия 1-го порядка. Р-ия будет иметь 2-ой порядок если прямая линия получится в координатах
получится прямая линия, то р-ия 1-го порядка. Р-ия будет иметь 2-ой порядок если прямая линия получится в координатах ![]() . Для р-ии 3-го порядка линия зависимости наблюдается в координатах
. Для р-ии 3-го порядка линия зависимости наблюдается в координатах ![]() . 3) р-ию проводят 2 раза с разложением начальных концентр. Каждый раз определяют время полупревращения. Если окажется, что время полупревращения не зависит от начальных концентраций, значит р-ия первого порядка, т.к.
. 3) р-ию проводят 2 раза с разложением начальных концентр. Каждый раз определяют время полупревращения. Если окажется, что время полупревращения не зависит от начальных концентраций, значит р-ия первого порядка, т.к. ![]() . Если во втором опыте начальная концентрация была увеличена в 2 раза, а время полупревращения уменьшилось в 2 раза, значит р-ия 2-го порядка, т.к.
. Если во втором опыте начальная концентрация была увеличена в 2 раза, а время полупревращения уменьшилось в 2 раза, значит р-ия 2-го порядка, т.к. ![]() . Для р-ии 3-го порядка при том же самом условии время полупревращения уменьшится в 4 раза, т.к.
. Для р-ии 3-го порядка при том же самом условии время полупревращения уменьшится в 4 раза, т.к. ![]() . В общем случае если порядок
. В общем случае если порядок ![]() ,
, ![]() .
.
Если начальные концентрации ![]() , то
, то ![]() , если
, если ![]() , то
, то ![]() . Поделив, получим
. Поделив, получим ![]() . Логарифмируя, получим
. Логарифмируя, получим ![]() ,
, ![]() . Это соотношение сохранится и в случае определения времени превращения любой доли концентрации
. Это соотношение сохранится и в случае определения времени превращения любой доли концентрации ![]() . Прежде рассмотрим диф. метод Вант-Гоффа. В основе метода лежит Ур
. Прежде рассмотрим диф. метод Вант-Гоффа. В основе метода лежит Ур ![]() . пусть измеряемое
. пусть измеряемое![]() ,
, ![]() ,
, ![]() - текущая концентрация исходного вещества в момент времени 1 и 2.
- текущая концентрация исходного вещества в момент времени 1 и 2. ![]() . После логарифмирования
. После логарифмирования ![]() ,
, ![]() (1). Скорость р-ии при концентрации
(1). Скорость р-ии при концентрации ![]() и
и ![]() определяется из зависимости
определяется из зависимости![]() .
. ![]() ,
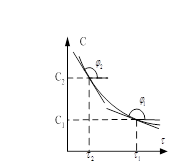
, ![]() Часто получают не всю кривую
Часто получают не всю кривую ![]() , а производную определённой скорости при 2 концентрациях. Принимая, что
, а производную определённой скорости при 2 концентрациях. Принимая, что ![]() ,тогда
,тогда ![]() .
. ![]() Для определения ΔС измеряем концентрации вещества в какой-то момент времени и через небольшой промежуток Δτ. Графический вариант метода Вант-Гофа W=KCn прологарифмируем
Для определения ΔС измеряем концентрации вещества в какой-то момент времени и через небольшой промежуток Δτ. Графический вариант метода Вант-Гофа W=KCn прологарифмируем ![]() => является линейной функцией lgC. Определяя скорость при нескольких концентрациях, строят график lgW-lgC tgα=n. Скорость р-ии W в различный момент времени определяется как и в предыдущем случае, но тангенс угла наклона касательной к положительному направлению оси абсцисс. Определяемый таким образом порядок р-ии называется временным порядком, он учитывает влияние на порядок продолжительности р-ии. Если использовать несколько кинетических кривых, то получим истинный порядок р-ии. Время и концентрация порядка могут не совпадать. Метод изоляции. Получим выражение для константы скорости р-
=> является линейной функцией lgC. Определяя скорость при нескольких концентрациях, строят график lgW-lgC tgα=n. Скорость р-ии W в различный момент времени определяется как и в предыдущем случае, но тангенс угла наклона касательной к положительному направлению оси абсцисс. Определяемый таким образом порядок р-ии называется временным порядком, он учитывает влияние на порядок продолжительности р-ии. Если использовать несколько кинетических кривых, то получим истинный порядок р-ии. Время и концентрация порядка могут не совпадать. Метод изоляции. Получим выражение для константы скорости р-
