Алкилирование фенолов
В ряде случаев алкилирование олефинами протекает под влиянием инициаторов радикально-цепных реакций, освещения или высокой температуры. Здесь промежуточными активными частицами являются свободные радикалы. Реакционная способность разных олефинов при таких реакциях значительно сближается.
Хлорпроизводные являются алкилирующими агентами наиболее широкого диапазона действия. Они пригодны для С-, О-, S- и N-алкилирования и для синтеза большинства элементо- и металлорганических соединений. Применение хлорпроизводных рационально для тех процессов, в которых их невозможно заменить олефинами или когда хлорпроизводные дешевле и доступнее олефинов.
Алкилирующее действие хлорпроизводных проявляется в трех различных типах взаимодействий: в электрофильных реакциях, при нуклеофильном замещении и в свободно-радикальных процессах. Механизм электрофильного замещения характерен для алкилирования по атому углерода, но, в отличие от олефинов, реакции катализируются только апротонными кислотами (хлориды алюминия, железа). В предельном случае процесс идет с промежуточным образованием карбокатиона:
![]()
в связи, с чем реакционная способность алкилхлоридов зависит от поляризации связи C-CI или от стабильности карбокатионов и повышается при удлинении и разветвлении алкильной группы:
![]()
При другом типе реакций, характерном для алкилирования по атомам кислорода, серы и азота, процесс состоит в нуклеофильном замещении атома хлора. Механизм аналогичен гидролизу хлорпроизводных, причем реакция протекает в отсутствие катализаторов:
![]()
Реакционная способность хлорпроизводных изменяется в данных процессах таким же образом, как при гидролизе, а именно:
ArCH2CI > CH2=CH-CH2CI > AIkCI > ArCI
перв-AIkCI > втор-AIkCI > трет-AIkCI
Целый ряд процессов алкилирования хлорпроизводными протекает по свободно-радикальному механизму. Это особенно характерно для синтезов элементо- и металлорганических соединений, когда свободные радикалы образуются за счет взаимодействия с металлами:
4PbNa + 4C2H5CI → 4Pb + 4NaCI + 4C2H![]() → 4NaCI + Pb(C2H5)4 + 3Pb
→ 4NaCI + Pb(C2H5)4 + 3Pb
Спирты и простые эфиры способны к реакциям С-, О-, N- и S-алкилирования. К простым эфирам можно отнести и оксиды олефинов, являющиеся внутренними эфирами гликолей, причем из всех простых эфиров только оксиды олефинов практически используют в качестве алкилирующих агентов. Спирты применяют для О- и N-алкилирования в тех случаях, когда они дешевле и доступнее хлорпроизводных. Для разрыва их алкил-кислородной связи требуются катализаторы кислотного типа:
+
R-OH + H+ ↔ R-OH2 ↔ R+ + H2O
3. Энергетическая характеристика основных реакций алкилирования
В зависимости от алкилирующего агента и типа разрывающейся связи в алкилируемом веществе процессы алкилирования имеют сильно различающиеся энергетические характеристики. Значения тепловых эффектов для газообразного состояния всех веществ в некоторых важных процессах алкилирования по С-, О- и N-связям приведены в таблице 1. Так как они существенно зависят от строения алкилирующих веществ, то в таблице приводятся наиболее часто встречающиеся пределы изменения тепловых эффектов.
Таблица 1
Тепловой эффект важнейших реакций алкилирования
|
Алкилирующий агент |
Разрываемая связь |
|
|
1 |
2 |
3 |
|
RCH=CH2 |
Салиф-Н |
84-100 |
|
Сар-Н |
96-104 | |
|
О-Н |
50-63 | |
|
RCI |
Сар-Н |
34-42 |
|
О-Н |
0 | |
|
N-H |
0-25 | |
|
ROH |
О-Н |
0-21 |
|
N-H |
21-42 | |
|
|
О-Н |
88-104 |
|
CH=CH |
О-Н |
100-117 |
Из сравнения приведенных данных видно, что при использовании одного и того же алкилирующего агента теплота реакции при алкилированием по разным атомам уменьшается в следующем порядке Сар > Салиф > N > O, а для разных алкилирующих агентов изменяется так:
![]()
Особенно большой тепловой эффект алкилирования с участием этиленоксида и ацетилена обусловлен значительной напряженностью трехчленного оксидного цикла и высокой эндотермичностью соединений с тройной связью.
2. Химия и теоретические основы алкилирования фенолов
Фенолы образуют с AICI3 неактивные соли ArOAICI2, поэтому для алкилирования фенолов в качестве катализаторов применяют протонные кислоты или металлоксидные катализаторы кислотного типа. Это позволяет использовать в качестве алкилирующих агентов только спирты и олефины. Наряду с продуктами замещения в ядре получается немного простых эфиров фенола, которые легко перегруппировываются в алкилфенолы:
![]()
Установлено, что алкилфенолы преимущественно образуются путем прямого алкилирования в ядро. Механизм этой реакции аналогичен механизму для ароматических углеводородов, причем гидроксогруппа фенолов сильно активирует в особенности 4- и 2-положения при почти полном отсутствии в продуктах мета-изомеров.
Алкилирование протекает последовательно с образованием моно-, ди, и триалкилфенолов, но одновременно происходит катализируемая кислотами перегруппировка с миграцией орто-алкильных групп с образованием пара-изомеров, которые в данном случае являются термодинамически наиболее стабильными. Таким образом, схема превращений следующая:
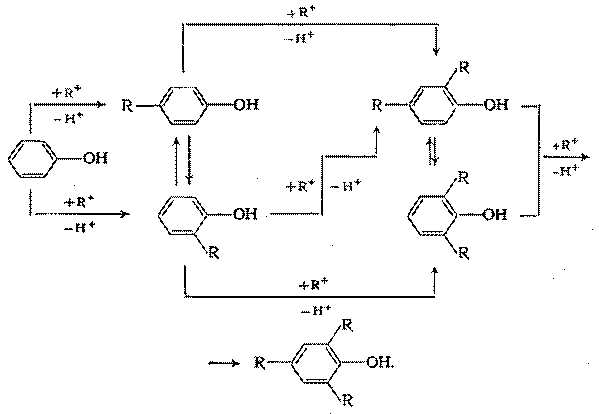
Из моноалкилфенолов при катализе протонными кислотами всегда преобладает пара-изомер, но при повышении активности катализатора, температуры и продолжительности реакции доля этого изомера среди монозамещенных может возрастать от 60 – 80 до 95% и более в связи с изомеризацией орто-изомера.
Из дизамещенных всегда значительно преобладает 2,4-диалкилфенол, доли которого еще больше растет при указанных выше условиях.
